科普驿站 第三十三期
主题:粘合素与DNA环
难度:B2
讲师:杜瑾鸿
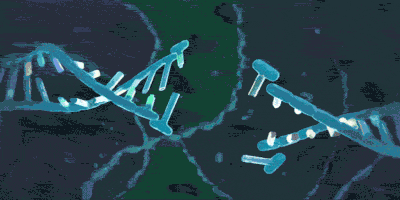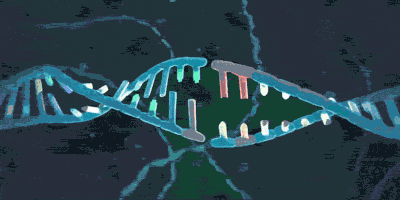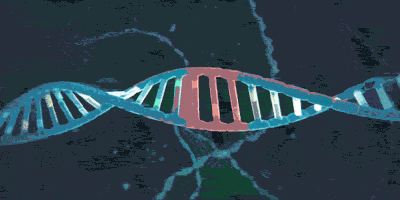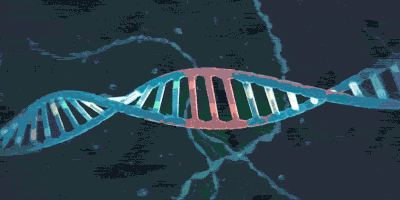
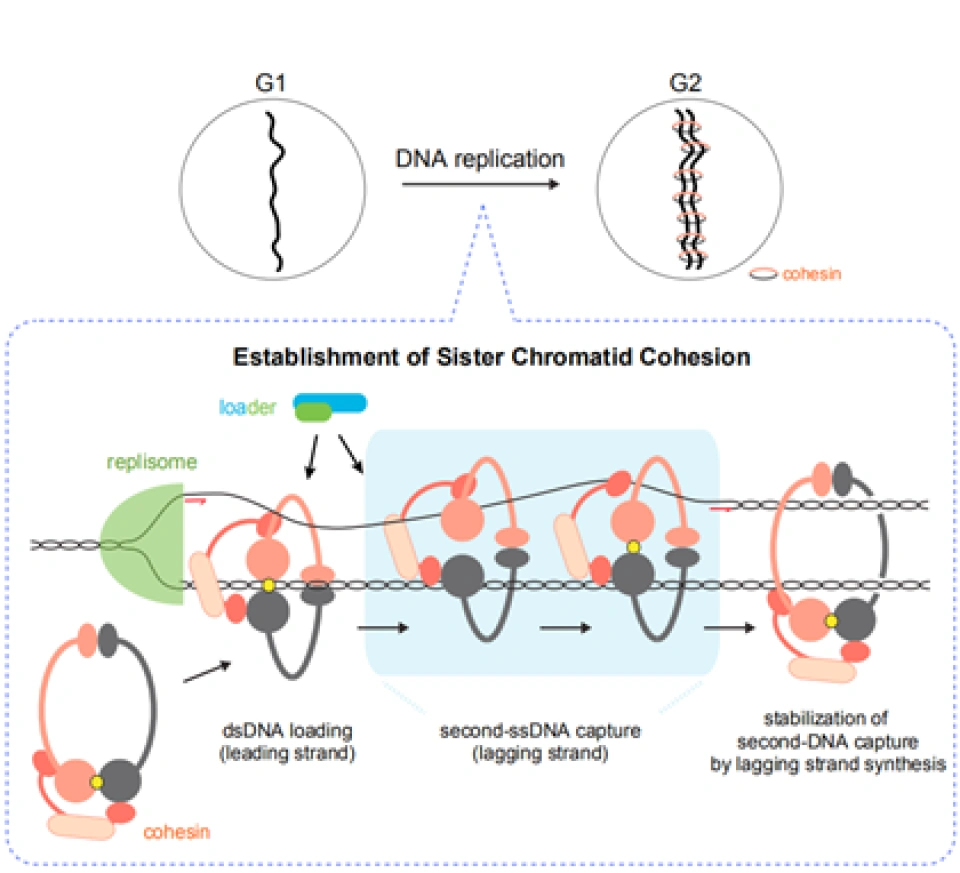
上期介绍了粘合素套住DNA,和从DNA上卸载下来的过程。但是实际上,如果你仅了解到了上述步骤,那么粘合素在细胞内实际的活动情况则也许比你想象的还要负责得多。它不仅可以套住一条DNA,也能套住两条DNA。2018年,由于荷兰科学家赛斯·德克尔(Cees Dekker)和他的团队的工作,我们有幸目睹了一种与粘合素相似的环蛋白——粘连蛋白(condensin,由SMC2,SMC4构成“Λ”形结构,Ycs4、Ycg1、Brn1等构成它的外门。它的套环、卸载等机制与粘合素很相似)套住DNA,并在没有能量供给的情况下拽动DNA的过程:
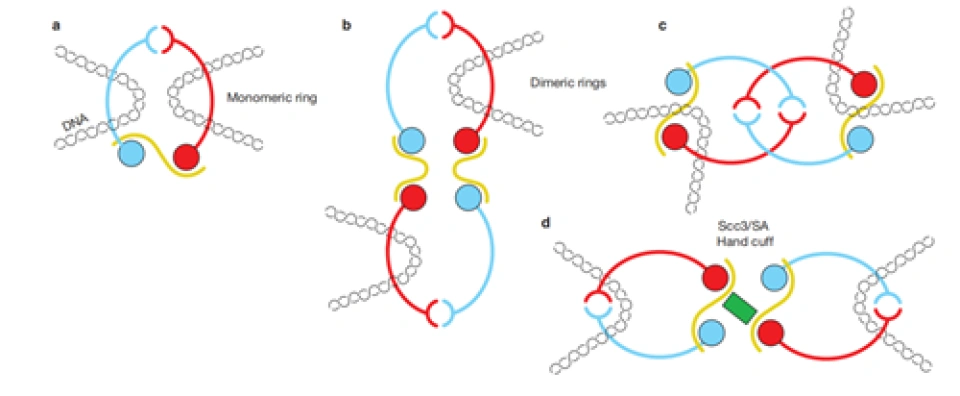
它的套环方式也可以多样地变化,例如单环(monomeric ring)、双环(dimeric rings),还有“手铐”(hand cuff):
了解到了以上,你就打开了新世界的大门。细胞对粘合素环的运用是极为巧妙和熟练的。比如说,它还可以与其他的蛋白质相互配合来发挥作用。一个生动的例子,就是它的转录调控。
让我们看看它在这个过程中是如何发挥作用的——在DNA上,存在一些能够特异性调控基因表达的片段,增强子(enhancer)就是其中的一种。这种DNA片段能够结合特定的蛋白质,然后由这些蛋白质与靶基因相互作用,从而加强靶基因的转录(表达)。但是在DNA上,有一些增强子同它的靶基因的“线距离”(即它们之间相隔的核苷酸单位的个数)是非常远的,有时会在不同的染色体上。虽然在细胞不分裂的时候,DNA以染色质丝的形式弥散在细胞核内,但是我们也不能指望DNA链随机地缠绕转动,就会如此巧合地让两个特定的位置相互靠近呀。怎么办呢?这个时候,粘合素就能发挥作用了。
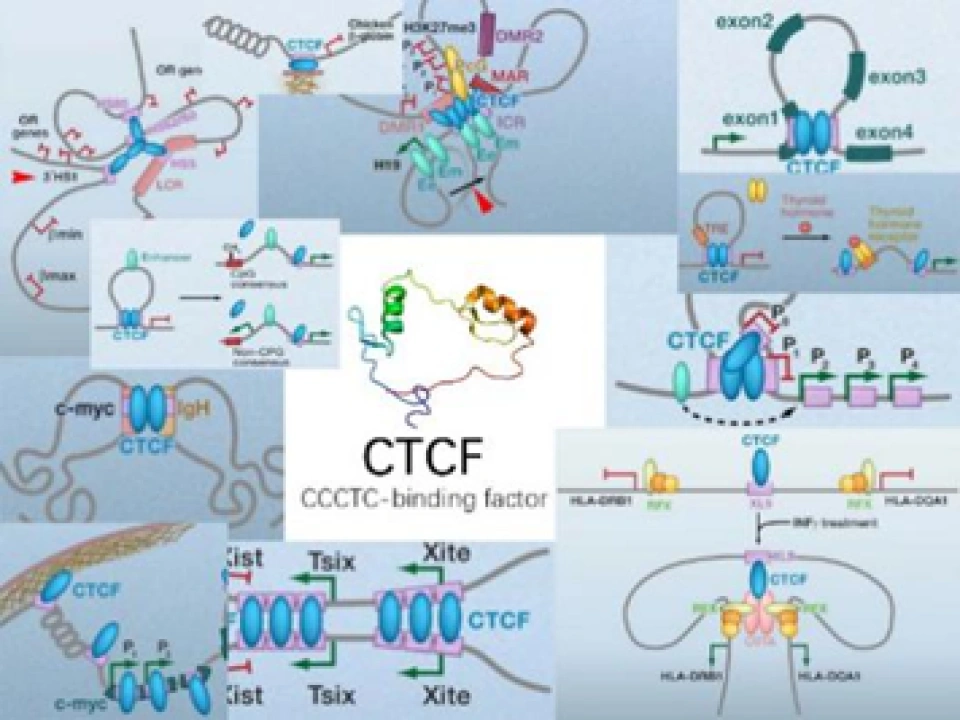
例如,它会与一种叫做CCCTC结合因子(CCCTC-binding factor, CTCF)的蛋白质相互配合。CTCF在科学家的研究中也是鼎鼎大名的,在各种各样的生化过程——包括RNA可变剪接、非编码RNA转录调控、DNA和组蛋白化学修饰等中,都能看到它的身影(如下图所示)。
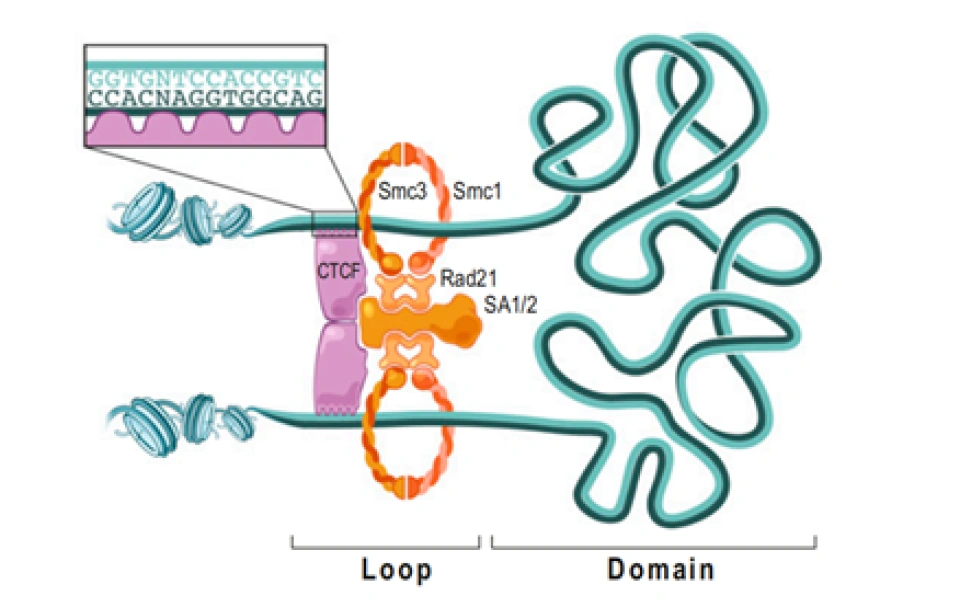
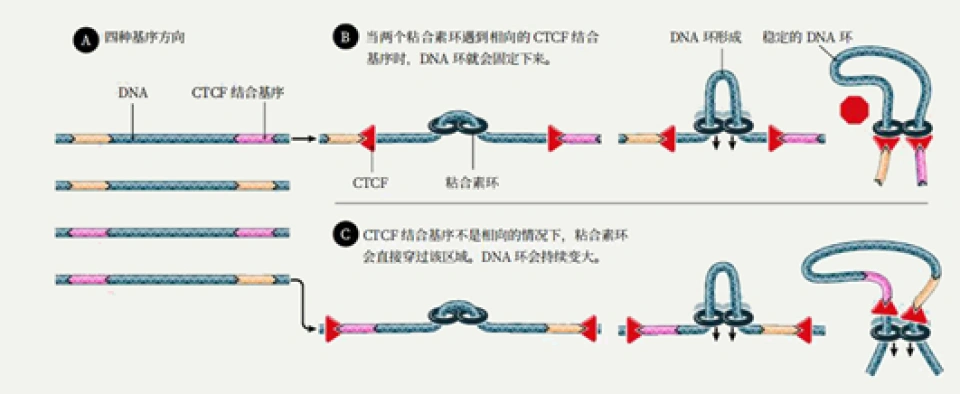
它有11个锌手指(zinc finger)结构域,“锌手指结构域”就是能与特定排列顺序的DNA片段结合的一种特殊的蛋白质空间结构,而且,不同的“锌手指”也能与不同的DNA片段结合。多个不同的锌手指组合起来,就可以结合各种各样的DNA,这就导致在基因组中能够与CTCF结合的DNA片段广泛存在,也可以说CCCTC不是唯一能与CTCF结合的DNA片段。CTCF彼此间能够相互结合,从而制造各种各样的形状的DNA,因此与组蛋白、粘合素、动粒蛋白等等一样,它也是染色质丝二级乃至超二级结构形成与调节的重要的蛋白质。但更重要的一点,它也能结合两种基质抗原SA-1和SA-2,这种结合只能发生在CTCF蛋白的一侧,这一侧我们可以看作是CTCF的“脸”。另一方面,我们刚才说CTCF能结合DNA上特定碱基排列方式的片段,然而值得注意的是,它与这样的片段结合是看方向的。5’-CCCTCCCCTCCCCTC-3’和3’-CCCTCCCCTCCCCTC-5’这两种排列方式,会导致CTCF面朝相反的链端与DNA结合。这将会意味着什么呢?基质抗原能够在自己的两侧各结合一个Rad21,所以它能将两个环连接在一起。
在一条DNA链上,可能结合着很多个CTCF,线距离很远的CTCF可能空间距离很近(尽管这样的几率也很小);而线距离比较近,乃至非常近的CTCF,反而会因为DNA无法大幅扭曲,而不会结合在一起。这个时候粘合素就可以派上用场。耦合的两个粘合素环在两个“面面相觑”(换言之,就是如果把DNA链拉直,结果你会发现两个CTCF与SA结合的部分(它们的“脸”)是相对向的)的CTCF之间形成,然后沿着DNA拽动滑行。如果碰到背朝自己的CTCF,粘合素环就会跳过这个CTCF;如果碰到面朝自己的CTCF,粘合素环就与之结合,直到两侧都被面朝自己的CTCF卡住为止。通过这种操作,DNA链上的增强子能够与基因相互靠近,从而增强基因的表达。CTCF与粘合素还可以相互配合完成其他很多操作,这只是其中比较有代表性,而且研究得比较详细的一种,它可以在同一条染色体上进行,也可以在不同的染色体上进行。
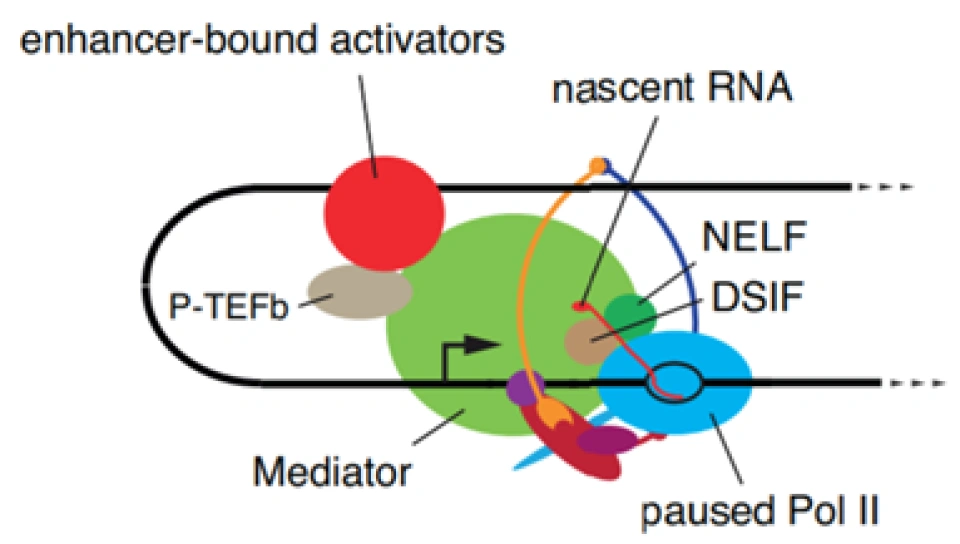
在使增强子与靶基因(的启动子)相互靠近后,也许就会是这样一幅场景:一个由几十个蛋白质组成的超大复合体——介导蛋白(mediator)被招募过来,参与对RNA聚合酶II、负延伸因子(negative elongation factor, NELF)、DRB敏感的诱导因子(DRB-sensitive inducing factor, DSIF)的磷酸化,并最终让转录的延伸继续下去。
但这只是粘合素能力的冰山一角!
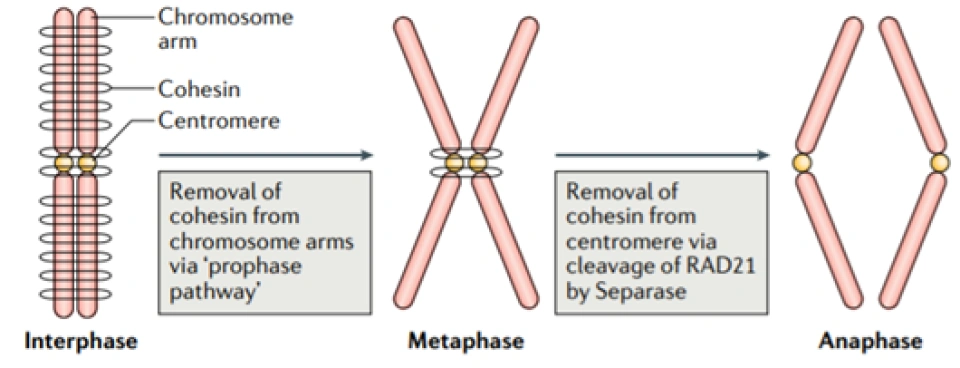
在有丝分裂的过程中也发现了它的身影:
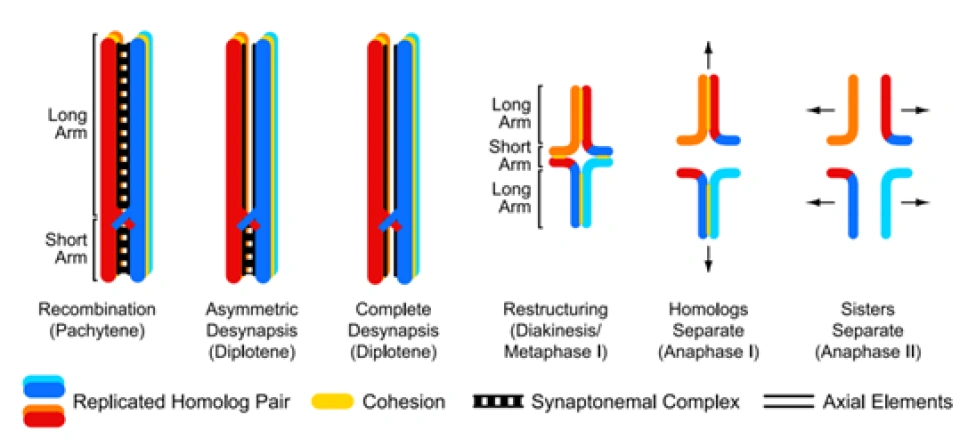
在减数分裂的四联体中:
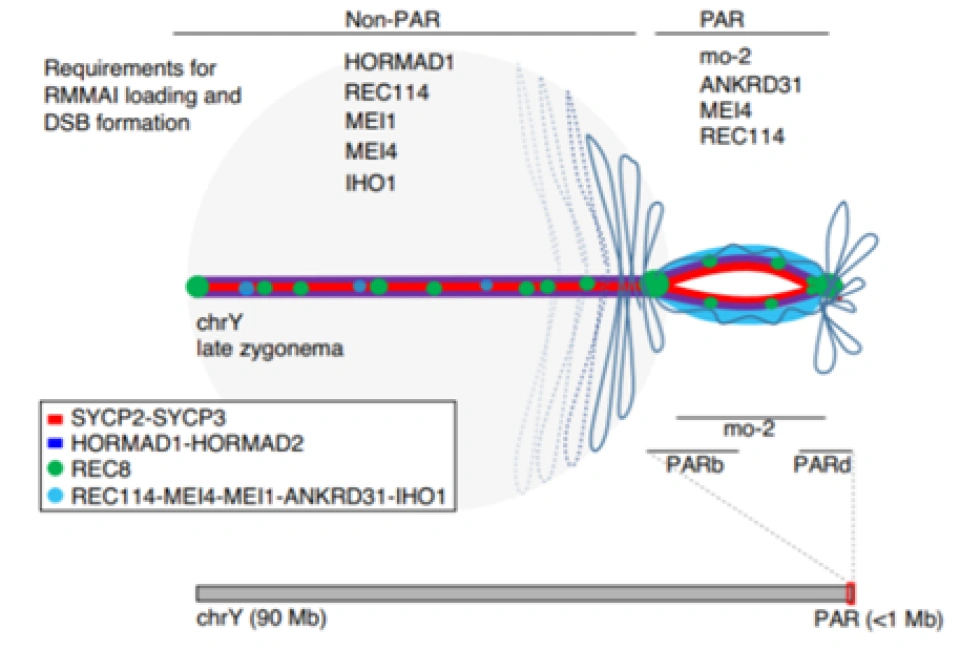
在XY染色体的配对中:
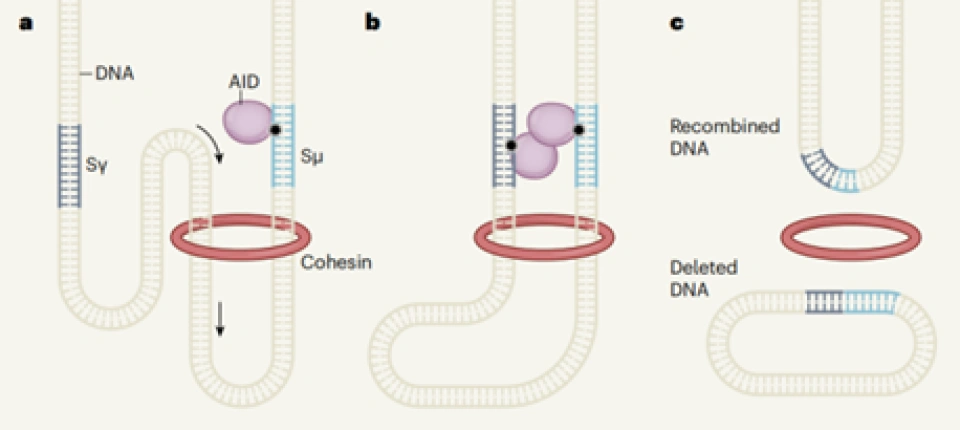
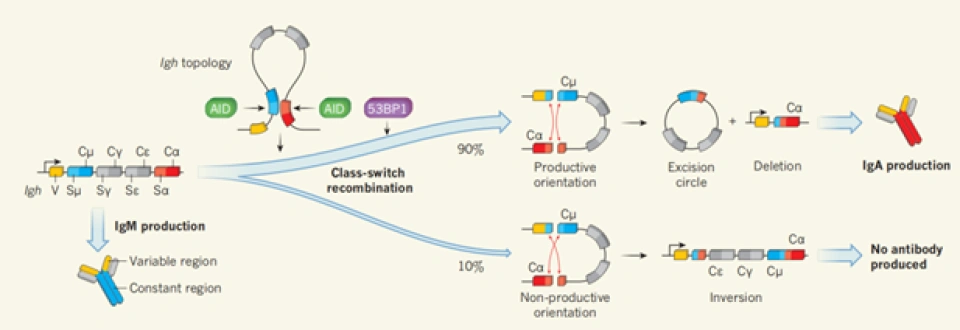
在免疫细胞的类开关重组(class-switch recombination)——浆细胞通过这种方式来产生具有不同功能的抗体——中:
因为粘合素以及粘连蛋白套环的方式特别多变,它们曾引起过长期的争议。它通过各种各样的套环方式,参与了很多相互作用,包括基因表达调控(上面说到的这种不是唯一的,还有很多种)。脊椎动物的性别决定机制、绝缘子活性、免疫基因V(D)J基因重组机制、染色质重塑等等,况且不论也许它能通过很多种方式分别参与这些相互作用。此外,粘合素的正常工作还需要更多的辅助蛋白质来参与调节,因此粘合素的作用网络是更加复杂的。
对粘合素的研究增进了我们对DNA二级结构的形成——包括最终通过卷曲螺旋形成染色体的了解。正因为它的功能真是太有特点了,在研究它时,我们不得不保持最高的谨慎,因为各种各样的DNA变化都有可能有它的参与——这样一来,就有可能会存在我们根本注意不到的盲区。不过也正由于包含着复杂的动态物理过程,以它为中心的互作网络中还有恐怕还有诸多不明之处。作者在众多的中文数据库中搜索粘合素和黏结蛋白,发现有关它们的中文资料异常稀少。关于这方面的空白,等着大家去补充。
Key publications & References
[1] Nasmyth, Kim. Cohesin: a catenase with separate entry and exit gates?[J]. Nature Cell Biology, 2011, 13(10):1170-1177.
[2] Nasmyth, K., & Haering, C. H. (2009). Cohesin: Its Roles and Mechanisms. Annual Review of Genetics, 43(1), 525–558. doi:10.1146/annurev-genet-102108-134233
[3] Murayama Y , Samora C P , Kurokawa Y , et al. Establishment of DNA-DNA Interactions by the Cohesin Ring[J]. Cell, 2018, 172(3):465-477.e15.
[4] Chao, W. C. H., Murayama, Y., Muñoz, S., Costa, A., Uhlmann, F., & Singleton, M. R. (2015). Structural Studies Reveal the Functional Modularity of the Scc2-Scc4 Cohesin Loader. Cell Reports, 12(5), 719–725. doi:10.1016/j.celrep.2015.06.071
[5] Murayama Y , Uhlmann F . DNA Entry into and Exit out of the Cohesin Ring by an Interlocking Gate Mechanism[J]. Cell, 2015, 163(7):1628-1640.
[6] Ladurner, R., Bhaskara, V., Huis in ’t Veld, P. J., Davidson, I. F., Kreidl, E., Petzold, G., & Peters, J.-M. (2014). Cohesin’s ATPase Activity Couples Cohesin Loading onto DNA with Smc3 Acetylation. Current Biology, 24(19), 2228–2237. doi:10.1016/j.cub.2014.08.011
[7] Weitzer, S., Lehane, C., & Uhlmann, F. (2003). A Model for ATP Hydrolysis-Dependent Binding of Cohesin to DNA. Current Biology, 13(22), 1930–1940. doi:10.1016/j.cub.2003.10.030
[8] Livak, F., & Nussenzweig, A. (2019). One ring to rule them all. Nature. doi:10.1038/d41586-019-03200-4
[9] Chan, K.-L., Roig, M. B., Hu, B., Beckouët, F., Metson, J., & Nasmyth, K. (2012). Cohesin’s DNA Exit Gate Is Distinct from Its Entrance Gate and Is Regulated by Acetylation. Cell, 150(5), 961–974. doi:10.1016/j.cell.2012.07.028
[10] Sanborn, A. L., Rao, S. S. P., Huang, S.-C., Durand, N. C., Huntley, M. H., Jewett, A. I., … Aiden, E. L. (2015). Chromatin extrusion explains key features of loop and domain formation in wild-type and engineered genomes. Proceedings of the National Academy of Sciences, 112(47), E6456–E6465. doi:10.1073/pnas.1518552112
[11] Aragon, L., Martinez-Perez, E., & Merkenschlager, M. (2013). Condensin, cohesin and the control of chromatin states. Current Opinion in Genetics & Development, 23(2), 204–211. doi:10.1016/j.gde.2012.11.004
[12] Aaron F Severson, Barbara J Meyer. Divergent kleisin subunits of cohesin specify mechanisms to tether and release meiotic chromosomes[J]. Elife, 2014, 3(35):e03467.
[13] Susannah Rankin (2005) Sororin, the Cell Cycle and Sister Chromatid Cohesion, Cell Cycle, 4:8, 1039-1042, DOI: 10.4161/cc.4.8.1926
[14] Noia D , Javier M . Molecular biology: Unequal opportunity during class switching[J]. Nature, 2015.
[15] Shi Z , Gao H , Bai X C , et al. Cryo-EM structure of the human cohesin-NIPBL-DNA complex[J]. Science, 2020:eabb0981.
[16] Brieño-Enríquez, M. A., Moak, S. L., Toledo, M., Filter, J. J., Gray, S., Barbero, J. L., … Holloway, J. K. (2016). Cohesin Removal along the Chromosome Arms during the First Meiotic Division Depends on a NEK1-PP1γ-WAPL Axis in the Mouse. Cell Reports, 17(4), 977–986. doi:10.1016/j.celrep.2016.09.059
[17] Ganji, M., Shaltiel, I. A., Bisht, S., Kim, E., Kalichava, A., Haering, C. H., & Dekker, C. (2018). Real-time imaging of DNA loop extrusion by condensin. Science, 360(6384), 102–105. doi:10.1126/science.aar7831
[18] Phillips, J. E., & Corces, V. G. (2009). CTCF: Master Weaver of the Genome. Cell, 137(7), 1194–1211. doi:10.1016/j.cell.2009.06.001
Figure origins
第1面上:Ref.[7]
第1面中:维基百科+作者PS
第1面下:Ref.[15]
第2面上:Ref.[2]+作者PS
第2面中:Ref.[6]
第2面下:Ref.[2]+作者PS
第3面上:https://www.cst-c.com.cn/contents/resources-protein-domains-interactions/heat-protein-domain/domains-heat
第3面下:Ref.[11]
第4面上:Ibid.
第4面下:Ref.[5]
第5面:Ref.[16]
第6面上:Ref.[17]
第6面下:Ref.[1]
第7面上:Ref.[18]
第7面下:Ref.[10]
第8面上:《环球科学》2019.4 p49+作者PS
第8面中:Dorsett, D., & Merkenschlager, M. (2013). Cohesin at active genes: a unifying theme for cohesin and gene expression from model organisms to humans. Current Opinion in Cell Biology, 25(3), 327–333. doi:10.1016/j.ceb.2013.02.003
第8面下:Ref.[3]
第9面(1):Waldman T . Emerging themes in cohesin cancer biology[J]. Nature Reviews Cancer, 2020.
第9面(2):Ref.[12]
第9面(3):Acquaviva, L., Boekhout, M., Karasu, M.E. et al. Ensuring meiotic DNA break formation in the mouse pseudoautosomal region. Nature (2020). https://doi.org/10.1038/s41586-020-2327-4
第9面(4):Ref.[8]
第9面(5):Ref.[14]



![[s-70]](https://www.bokeyuan.net/pic/image/emoji/cas/70.png)












