科普驿站 第二十四期
科目:生物
难度:B2
讲师:杜瑾鸿
调节合成HIF-1α的过程
HIF-1α的非氧依赖性调控途径不是唯一的,而是纷繁复杂的。如生长因子、活性氧自由基(尤其是来自线粒体的活性氧、过氧化氢和超氧自由基)和金属离子还有各种蛋白的信号通路。免疫细胞因子或者炎症介质比如白细胞介素、肿瘤坏死因子、NF-κB、一氧化氮、原癌基因和抑癌基因、生长因子等等,都能调控HIF-1α的表达。可是,它们不见得是以相同的方式激活HIF-1α的。所以也只能介绍其中非常重要的一种调控方式。这种调控方式是由两个途径构成的,它们分别为PI3K/Akt/HIF-1α途径和MAPK/HIF-1α途径。
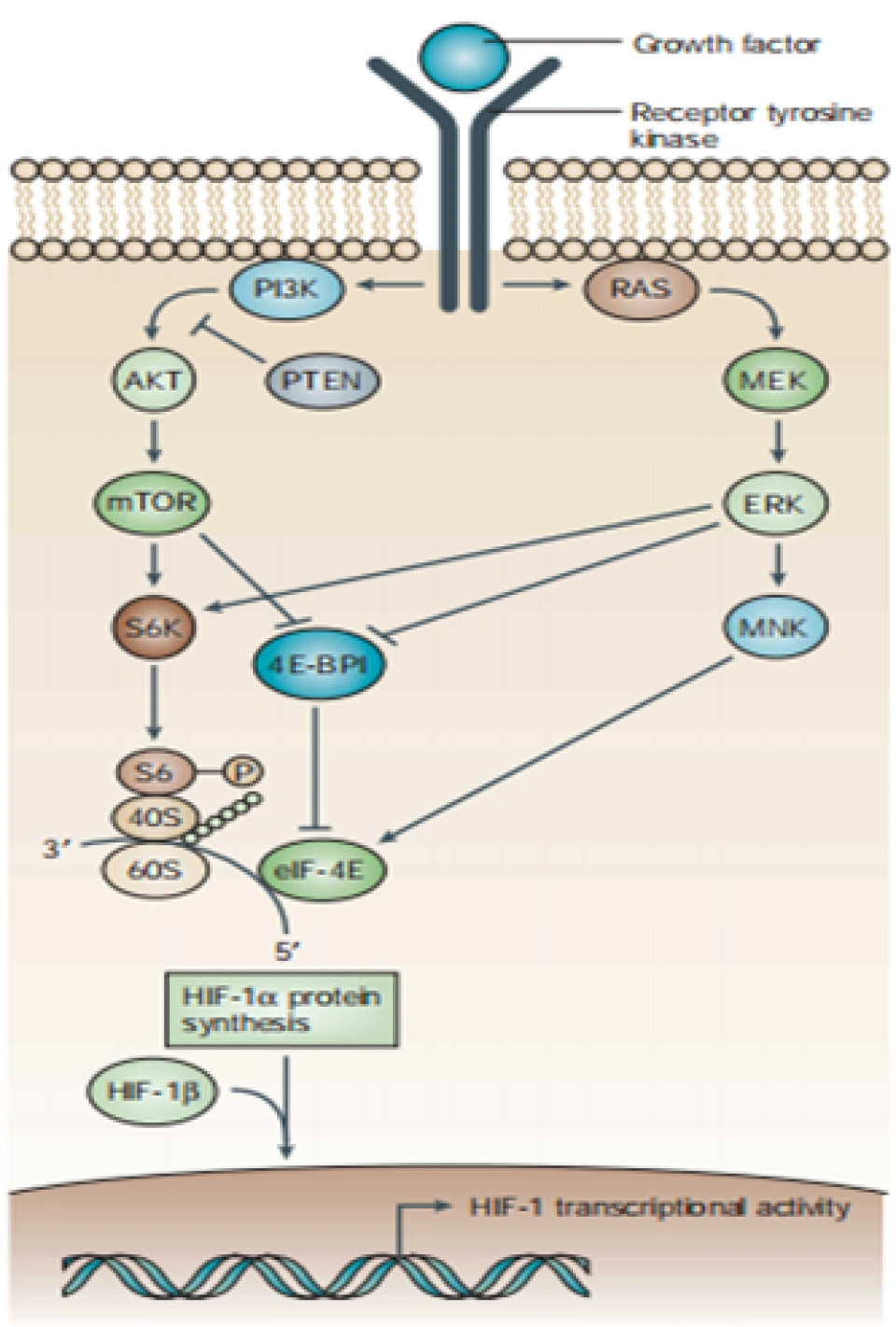
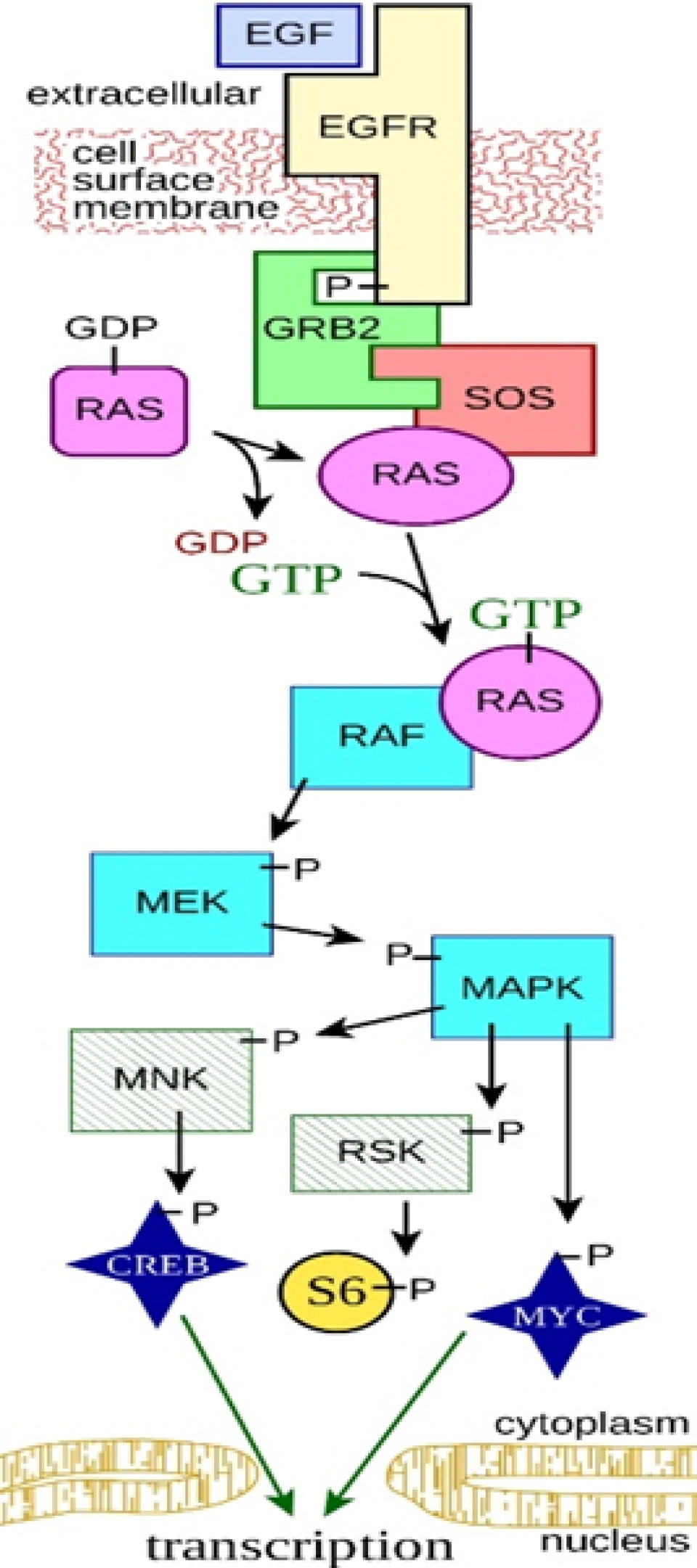
与缺氧诱导的HIF-1α“负减少”增加不同,生长因子受体是通过复杂的通路来激活HIF-1α的合成也就是“正增加”来提高HIF-1α通路的。一方面,当生长因子结合到它们的受体酪氨酸激酶上(受体与配体结合后构象发生变化,导致具有酪氨酸激酶活性的区域暴露出来),后者就会激活磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase, PI3K)和丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)通路。PI3K激活丝氨酸/苏氨酸激酶AKT(serine/threonine kinase AKT,又叫蛋白激酶B(PKB))。磷酸化与张力蛋白同源蛋白(phosphatase and tensin homolog, PTEN) 能够抑制这步的激活,AKT又去激活哺乳动物雷帕霉素靶蛋白(mammalian target of repamycin, mTOR,雷帕霉素是一种大环内酯类抗生素)。另一方面,受体酪氨酸激酶会使结合着二磷酸鸟苷(GDP)的Ras蛋白,(Ras超家族,一个小GTP酶超家族,里面含有上百种蛋白质的Ras亚家族,这个家族有好几十个成员。Ras是大鼠肉瘤(rat sarcoma)的缩写,因为它最初是在哈弗里(Harvery)鼠肉瘤病毒(Ha-MSV)和克尔斯腾(Kirsten)鼠肉瘤病毒(Ki-MSV)的子代基因中被发现的。)也就是Ras-GDP,转化成活化形式的Ras-GTP。这一步是怎么做到的呢?
原来是受体酪氨酸激酶结合了另外两个蛋白质——生长因子受体结合蛋白2(growth factor receptor-bound protein 2,GRB2)、鸟嘌呤核苷交换因子(Son of sevenless, SOS)。在这两个蛋白质的作用下,Ras-GDP解体,Ras结合到SOS上,然后Ras脱离SOS并与GTP结合。Ras-GTP与Raf(Ras超家族的另一个成员。Raf是rapidly accelerated fibrosarcoma即“迅速加快的纤维肉瘤”的缩写)结合,从而将GTP上的一个磷酸基转移到MAP/ERK激酶(MAP/ERK kinase, MEK)上,(MAP是microtubule-associated protein即微管相关蛋白的意思,读者不要根据前面的MAPK而强行推理。ERK的意思见下。)MEK从而将胞外信号调节的激酶(extracellular-signal-regulated kinase, ERK)磷酸化从而将其激活。ERK接着激活MAPK互作激酶(MAPK-interacting kinase, MNK)。(由MEK→MAPK→MNK的路径也可以激活MNK。MAPK是一个枢纽,它可以激活很多蛋白质,从而引发各种各样的效应。MAPK还可以把HIF-1α的641号、643号氨基酸(都是丝氨酸)以及796号氨基酸(是一个苏氨酸)磷酸化。由于苏氨酸位于TAD-C内部,因此796号氨基酸的磷酸化将大大增强HIF-1α的转录活性(因为它显著增强了HIF-1α与CBP的结合能力)。
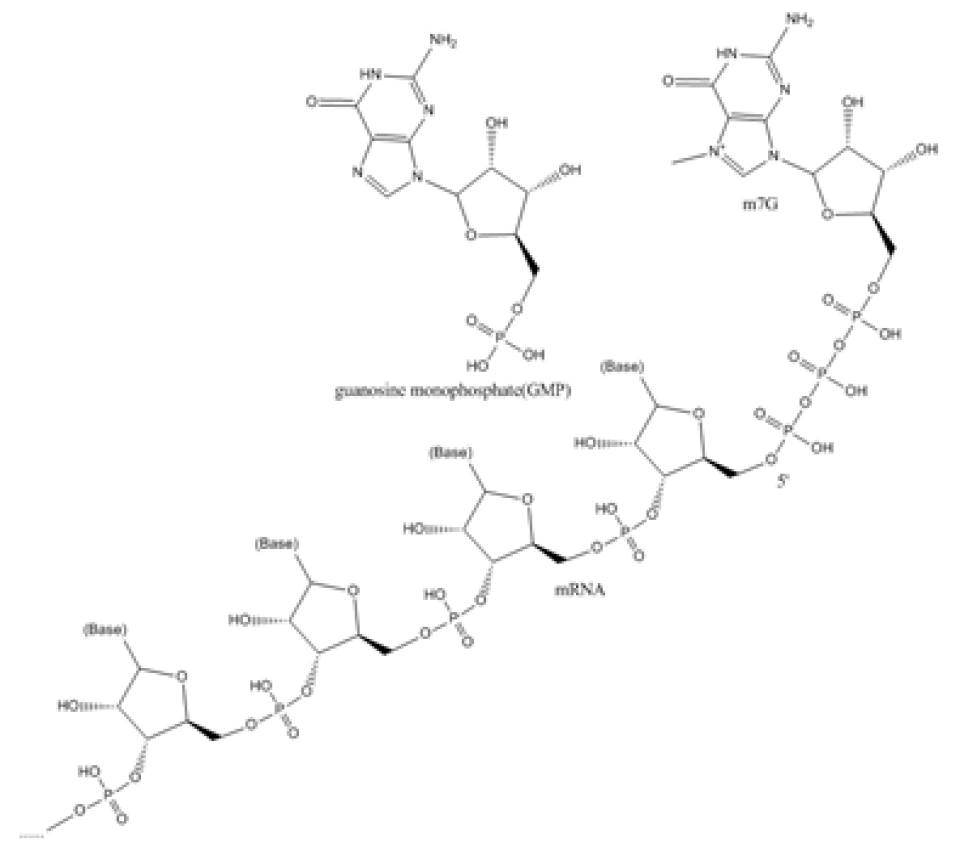
ERK可以与mTOR协同作用,将p70 S6激酶(p70 S6 kinase,S6K)和真核生物翻译起始因子 4E(eukaryotic translation initiation factor 4E,eIF-4E)结合蛋白1(4E-BP1)这两个蛋白质分别加上一个磷酸基。S6K将会为核糖体的组成部分之一——“S6亚基”蛋白质加上一个磷酸基;同时,4E-BP1没有被磷酸化的时候与eIF-4E结合着,从而抑制了mRNA的翻译。这主要是因为4E-BP1导致eIF-4E没有办法识别mRNA的“帽子”——转录、剪接的过程中,细胞会对RNA进行很多其他的加工。比较重要的就是加帽和加尾。在pre-mRNA转录出25个碱基时,mRNA的5’端就会结合一个7号原子(位于碱基上)被甲基化的鸟嘌呤核苷酸(m7G),这个过程被称为加帽。具体来说,鸟嘌呤核苷酸5’端的磷酸基,与(pre-)mRNA的游离磷酸基,结合在一个磷酸分子上,也就是说鸟苷与mRNA中间有三个磷酸基,即m7G-P-P-P-mRNA。这导致mRNA实质上没有5’端而有两个3’端。
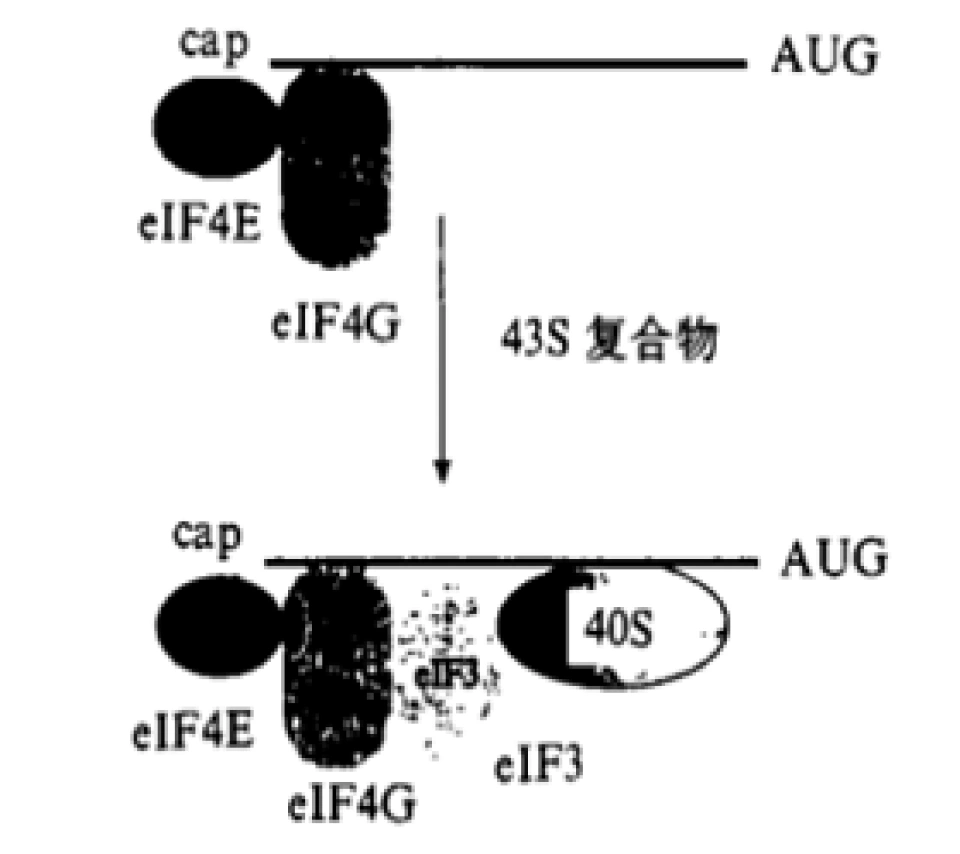
如果没有这个帽子,mRNA就很难被运出细胞核。此外,被修饰过的mRNA不存在游离的磷酸基,所以对碱性的磷酸酶稳定,这个帽子可以保护mRNA使其不被降解。此外,翻译也一定是从加帽的这一端开始的。eIF-4E能够结合到这个帽子。eIF-4E结合到帽子之后,再招募eIF-4G,后者再与eIF-3结合,eIF3则去结合核糖体的40S小亚基,从而使核糖体与起始密码子相互识别。再如,大部分pre-mRNA在复制完成后,3’端会被加上一段序列,其特征是含有很多个腺嘌呤核糖核苷酸(或者说A在其中占绝对多数)。这则被称作加尾,长200-250个碱基。加上的尾巴叫做多聚腺苷酸(poly-A)尾。研究发现,要是没有这个尾巴,这个尾巴太长,或者这个尾巴太短,都会导致mRNA滞留在细胞核内——因此也就无法起始转录。实际上,eIF-4E本来又叫帽子结合蛋白(can-binding protein)。E4-BP1被磷酸化以后,与eIL-4E的结合被破坏,导致与后者脱离,eIL-4E就能去结合mRNA的帽子。
eIF-4E结合到帽子之后,再招募eIF4G,后者再与eIF3结合,eIF3则去结合核糖体的40S小亚基(60S大亚基、40S小亚基中的“60S”“40S”都是沉降系数,前面曾有过说明),这样形成一个大复合体,从而能够使核糖体顺利地与起始密码子相互识别。
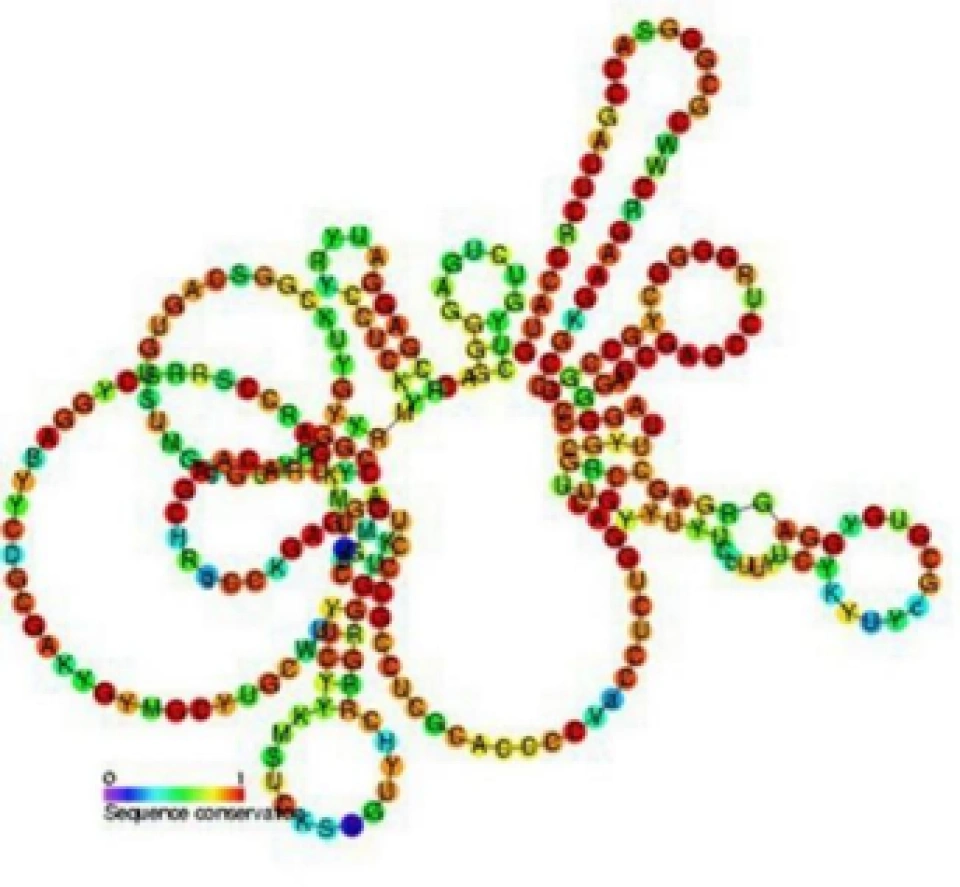
在2002年,有一项研究发现,这个依赖“帽子”识别的翻译起始过程需要消耗能量,(eIF-4E具有ATP水解酶活性。)在缺氧条件下能量可能难以供应。HIF-1α在缺氧条件下仍顺利起始翻译的一个可疑的手段,就是在它的mRNA的5’端的不翻译区域(5’ untranslated region,5’-UTR)形成了一个HIF-1α内部核糖体进入位点(internal ribosome entry site, IRES),这样可以使HIF-1α的mRNA直接跳过帽子识别这一步骤从而开始翻译。(它的可能结构如图所示。)
从以上可以看到,HIF-1α的表达调控是通过一些与其他蛋白质比较而言略显怪异的手法来进行的。为什么要这么做呢?这就要涉及到它的功能–由它的转录激活能力所引发的效应了。
HIF-1的转录调控及其宏观效应
HIF-1通过自己的刺激转录功能,间接参与了很多生理过程或者特征的形成、疾病的发生。比如,呼吸,尤其是无氧呼吸;比如,高海拔适应,还有免疫反应,胚胎发育,锻炼导致的一系列身体变化,代谢,贫血,癌症(肿瘤发生),中风,感染,心肌梗死,低氧性肺血管高压,伤口愈合,等等。读者可以看到,这些功能跟氧气息息相关。可以想象氧气对细胞的重要性。不是说非得空气中氧气含量降低才会引发缺氧。就是在正常氧含量(normoxia)条件下,在我们的日常生活中,我们的身体内部的某些地方随时可能会发生缺氧(hypoxia)事件。我们锻炼的时候就更是如此。
人体的血管并不会密集到隔一个细胞就有一根。离血管近的细胞近水楼台先得月,但是离血管远的细胞就相比之下更容易缺氧。就算假定所有的人体细胞都能自己摄取氧气,如果身体里没有血管,也不见得人就能保证不发生大面积缺氧。在那些离血管远的地方的细胞中,被缺氧激活的HIF-1的浓度增加,会促进血管发生(angiogenesis)。癌症——恶性肿瘤,为了摄取更多的营养,也会产生更多血管。HIF-1也能促进红细胞生成,正如前面所述,它能烈性地促进EPO的表达。伤口愈合的过程中也会制造相对缺氧的环境,那么HIF-1也能被表达,可以促进一揽子生长因子的分泌,从而促进细胞的增殖,来增加伤口愈合的速度。然而,它促进细胞增殖的功能也是它在正常氧条件下受抑制的原因,这就意味着它具有促癌症作用。在很多癌症组织中,可以检测到HIF-1的高表达。HIF-1不仅促进肿瘤产生血管争夺养分,而且促进细胞生长,从而加快肿瘤的扩大和扩散。
HIF-1二聚体形成以后,进入细胞核,它将结合到缺氧反应元件(hypoxia response element, HRE)上,刺激转录。当然,转录起始其实这是一个非常复杂的过程,需要招募过来很多蛋白质,包括氧化还原作用效应因子1(redox effector factor-1, Ref-1)、聚二磷酸核糖聚合酶(poly(ADP-ribose)polymerase 1, PARP1)、甾体受体共激活蛋白-1(steroid receptor coactivator-1, SRC-1)等辅助因子,还有聚合酶、细胞周期素、细胞周期素依赖性激酶以及延长因子等等,这个过程非常复杂。
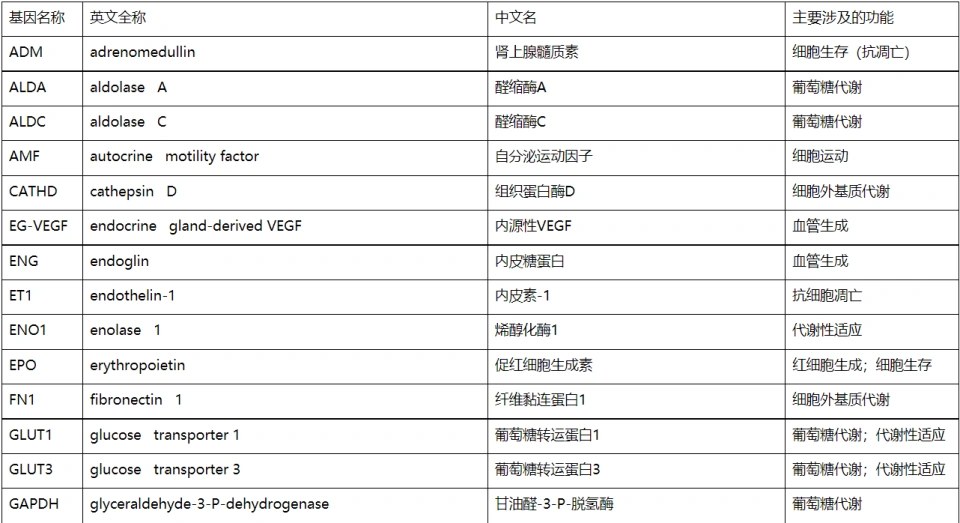
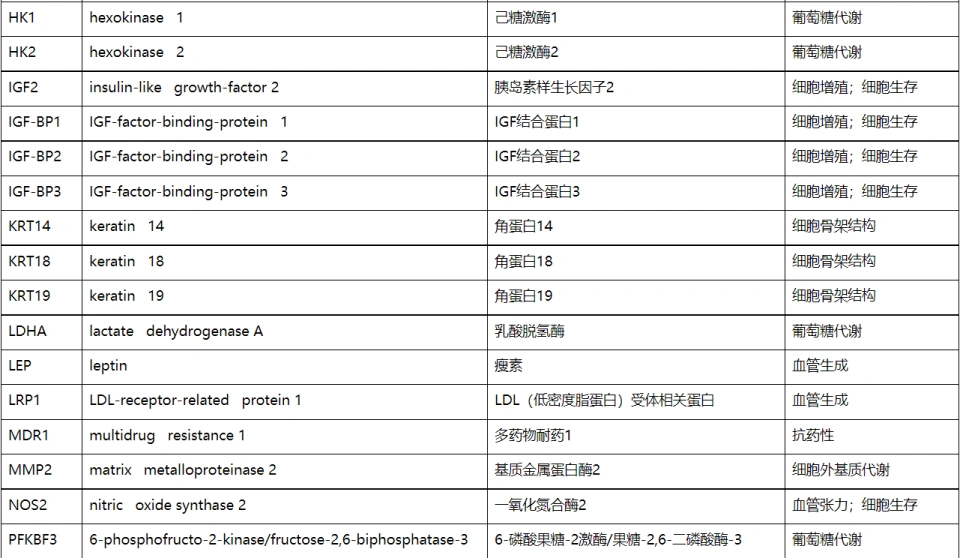
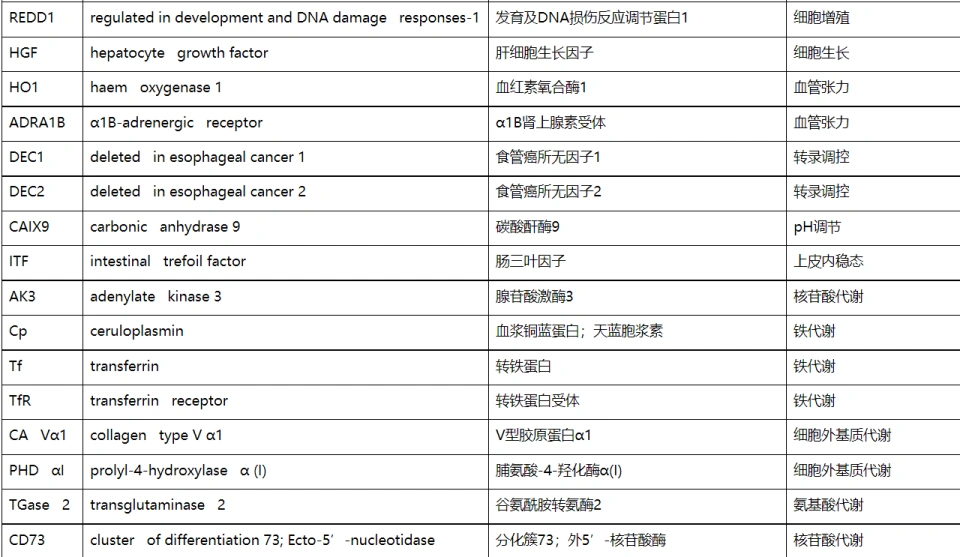
那HIF-1的靶基因有多少呢?300多个,可以想见这绝对不是单单一个HIF-1分子就能完成的工作。这些基因有着诸多功能,所以这些功能也就跟HIF-1挂钩。我们可以列一个名单:
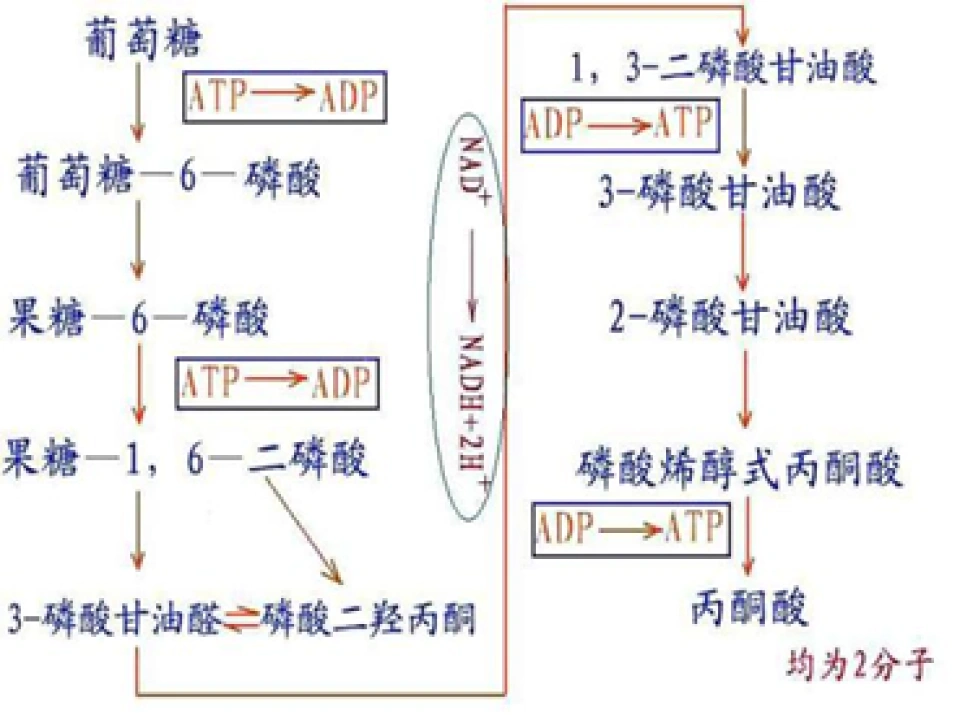
我们现在开始讨论细胞氧平衡。关于氧平衡和氧气水平变化感应的探索,其实已经产生过很多诺贝尔生理学或医学奖的得主,包括1931年奥拓·沃伯格(Otto Warburg),他在细胞呼吸所需的酶的探索方面大有建树;1938年柯内尔·海曼斯(Corneille Heymans),他对神经系统在呼吸和氧气水平变化应激的领域大有所为;以及1953年汉斯·阿道夫·克雷布斯(Hans A. Krebs)发现三羧酸循环)和弗里茨·阿尔伯特·李普曼(Fritz A. Lipmann)阐明辅酶A的作用,等等。但是在整个20世纪人们并没有找到氧气变化适应在基因水平的调控机制,而这就是赛门扎他们的发现所填补的空白。常规来说,细胞的有氧呼吸,有糖酵解:
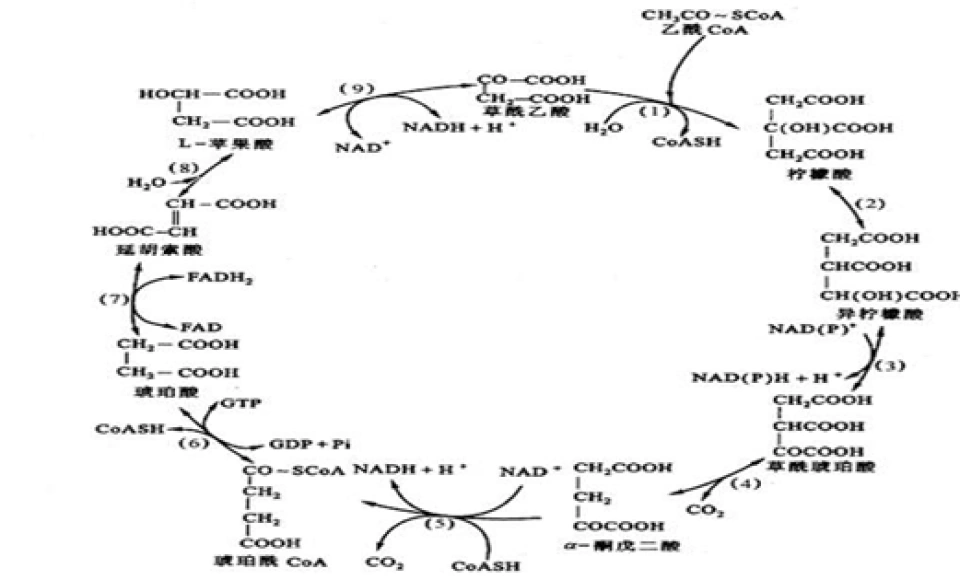
(丙酮酸氧化脱羧和)三羧酸循环(或者说柠檬酸循环或者说克雷布斯循环):
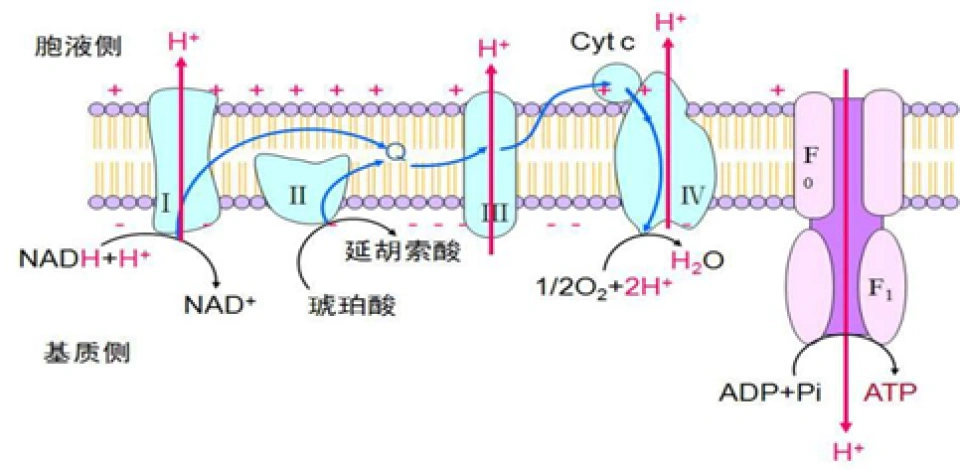
和氧化磷酸化——或者又叫电子呼吸链:
等等。它跟无氧呼吸重叠的环节有哪些呢?——糖酵解。(高中说无氧呼吸的第二阶段不会放出能量,不过严格来说其实会有一丁点。)糖酵解就是葡萄糖变成丙酮酸的过程,换言之就是有氧呼吸的第一阶段。
而从上面的表格中我们可以看到,HIF-1会刺激一揽子糖酵解基因的表达。这里有一个很有意思的问题,不知大家是否注意到。三羧酸循环(几乎可以看作高中所说的有氧呼吸第二阶段)在线粒体基质进行,是不消耗氧气的,也能产生与糖酵解过程相当的能量,为什么无氧时不能够进行呢?或者一个更加直白的问题,为什么HIF-1不刺激三羧酸循环相关酶的基因呢?
原因在于,这些反应需要还原性辅酶比如烟酰胺腺嘌呤二核苷酸(NADH)、黄素腺嘌呤二核苷酸(FADH2)在电子呼吸链中将自己的电子交给氧气,然后跑去参加三羧酸循环,所以三羧酸循环其实是间接地依赖氧气参与的。在有氧时,有氧呼吸的途径跟无氧呼吸竞争,压制了转化成乳酸的反应。当细胞缺氧时,由于三羧酸循环都无法进行,主要的制造能量的反应将会仰赖糖酵解。癌细胞快速增殖时所导致的供氧不足,就会使癌细胞产生大量乳酸。HIF-1通过刺激糖酵解相关酶的表达,促进糖酵解反应的水平升高,——尽管缺氧还是会导致产能下跌,但在缺氧时这种刺激作用仍弥补了一部分能量的不足。这可以说是HIF-1引发的短期效应之一。
HIF-1引发的第二个短期效应,就是激活肾上腺髓质素、促红细胞生成素、诱导性一氧化氮合酶2还有好几种生长因子的分泌。它们会阻碍缺氧引发的细胞凋亡。以促红细胞生成素为例,它与它的受体结合之后就会激活磷脂酰肌醇3-激酶(PI3K)/AKT信号途径,被磷酸化而激活的AKT蛋白就会将一些B淋巴细胞瘤蛋白(B-cell lymphoma-2, Bcl-2)家族的各种蛋白质磷酸化。这种磷酸化导致的是不同的效应,比如导致促凋亡的蛋白质Bcl-xL/Bcl-2相关死亡促进蛋白(Bcl-xL/Bcl-2-associated death promoter, Bad)的失活,和抗凋亡的蛋白质Bcl-xL被激活。
生长因子,我们到后来还会说到这种化学物质。它是一个比较模糊的概念,维生素、碱基之类的也可以算作是生长因子。高中生物的《选修一》就提到过生长因子,它们不会直接冠以生长因子的名头。很多蛋白质也是生长因子。我们给这些蛋白质命名的时候,可能会称它们为某某因子。那么这就是很庞大的蛋白质家族了,比如胰岛素样生长因子、成纤维细胞生长因子、血小板源性生长因子、骨肉瘤源性生长因子、神经生长因子、转化生长因子超家族、肝细胞生长因子、表皮生长因子、血管内皮生长因子等等。它们能抗凋亡、促进细胞生存、生长,也许还能促进增殖分裂。
HIF-1的这种短期效应在很多身体发生故障时尤为关键。它这样一来引发的抗凋亡、促进细胞存活、促进糖酵解供能的效果,在人比如遭受皮肤机械损伤的时候、心肌梗死和脑梗死的时候会发挥相当的作用。比如,有的科学家发现用渥曼青霉素(wortmannin)抑制PI3K途径,结果导致脑梗死或者中风的恢复情况变差。事实上,HIF-1已经成为应对脑梗死、神经退行性疾病以及贫血和中风的药物靶标。
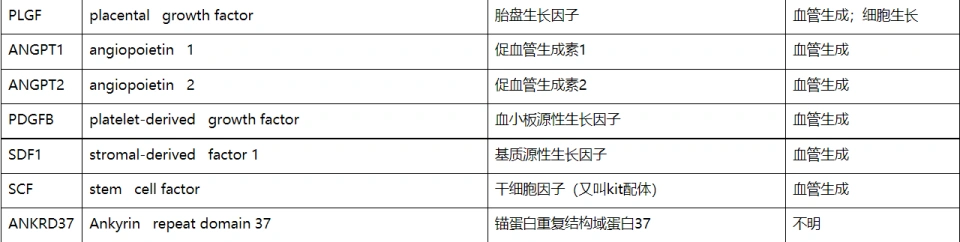
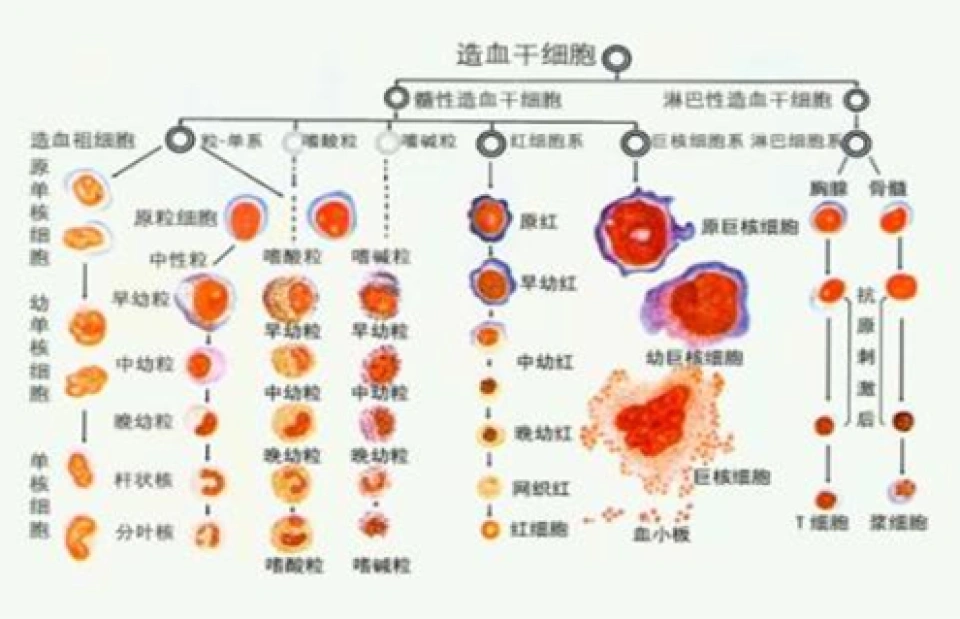
HIF-1也有长期效应,最著名的两个就是它能促进红细胞增加和产生新的血管。这两个效应对应的蛋白质,分别是促红细胞生成素,以及血管内皮生长因子、胎盘生长因子、促血管生成素、干细胞因子、基质源性生长因子等等。有科学家做了实验发现,如果把小鼠两个HIF-1α基因都敲除掉,换言之即制造隐形纯合子,那么小鼠在胚胎期就死亡,也就是说这种基因隐性致死。死因大约是心脏畸形、神经管缺陷、血管组织退化和大量的细胞死亡;如果只敲掉其中一个,那么虽然小鼠发育会正常,然而应对缺氧的能力会产生障碍。人们仔细研究了颈动脉体,那是一块粉红色只有几毫米大的卵圆形或者形状不规则的组织,在颈总动脉分叉处后方与动脉壁连在一起;它是一个呼吸感受器,而且是最大的副神经节,读者从此可略明白它扮演了何种角色。在杂合子小鼠体内,劲动脉体解剖学和组织学上都显示正常,对氰化物的反应也是正常的。但是杂合子小鼠的劲动脉体对转入持续性缺氧环境几乎没反应。这或许说明HIF-1α的杂合子的HIF-1α表达量,已经充分满足了发育的需要,然而却无法在缺氧时诱导足够的适应变化。EPO对骨髓里的细胞产生一系列作用——红细胞的分化,经历了多能干细胞或者多向祖细胞-髓系干细胞-早期红系祖细胞-晚期红系祖细胞-原红细胞-早期红细胞-网织红细胞-成熟红细胞的过程。
红细胞增加的效应是什么呢?我们的输氧供氧能力增强了,就会导致我们能以更大的限度从空气中获取氧气,同时也意味着我们能更长时间闭气。如果在高海拔地区居住的人来到低海拔地区,他们就更有可能成为运动健将。有的运动员,尤其是那些需要用到爆发力量的项目的运动员,在比赛前会去高原进行适应性训练,从而提高红细胞数量来增加身体机能。也正因为如此,有的人发表了对促红细胞生成素被制作成药物来人为提高身体机能从而获取比赛胜利的药物。那么,EPO或许会成为新的违禁药品。
而血管生成的路径就复杂一些。
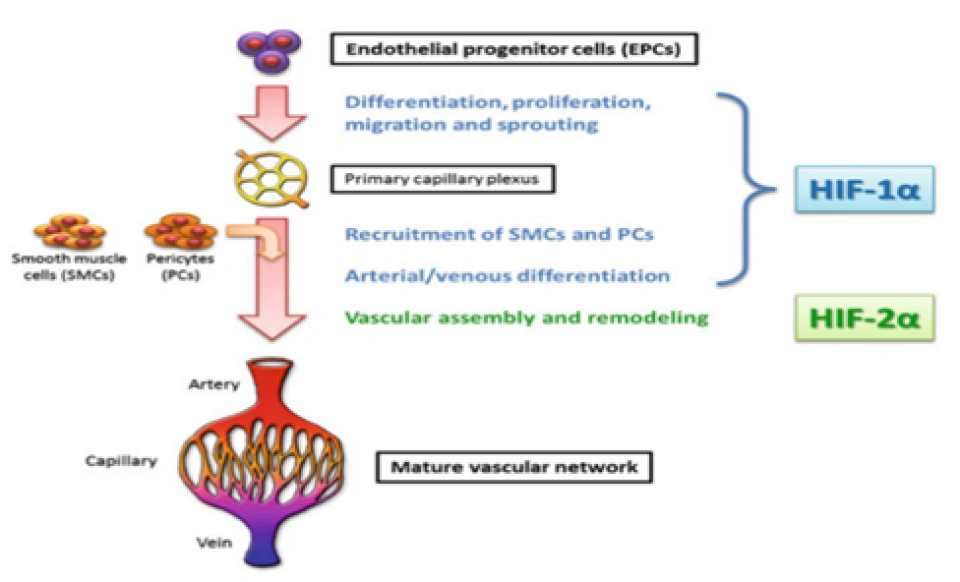
在人体内,首先是内皮祖细胞(endothelial progenitor cells)经过一系列迁移、增殖、分化等形成初级毛细血管丛,然后募集平滑肌细胞(smooth muscle cells)和周围细胞(pericytes),下一步就开始发生特异性分化,比如动脉和静脉等等的差别分化,最后再经过不断的重塑和修剪,形成成熟的血管网络。这种血管生成也在脑梗死的恢复中起了重要作用。血管的生成过程,在胚胎中这过程又有所不同。首先卵黄囊壁的胚外中胚层会出现一些所谓的血岛(blood islands),其实就是几簇血管细胞团。一方面,位于中央的游离细胞分化成造血干细胞,另一方面,周围的成血管细胞不断增生、迁移等等,分化成内皮细胞,生成新生血管丛。然后在一段时间内,很多种细胞都因为这些内皮细胞产生的一些化学物质比如血小板源性生长因子B(PDGF-B)、鞘氨醇-1-磷酸-1(sphingosine-1-phophate-1,S1P1)、转化生长因子β等等,从而帮助支持和稳定这些新生血管。后面的过程,诸如成熟、分化、重塑、修剪等等,才跟前面的差不多。事实上,HIF-1所激活的蛋白质的作用几乎贯穿了整个血管生成的过程。可想而知,HIF-1对胚胎发育是非常重要的,也正因如此,HIF-1α的基因是高度保守的,换言之即很少观察到携带它突变的活体。
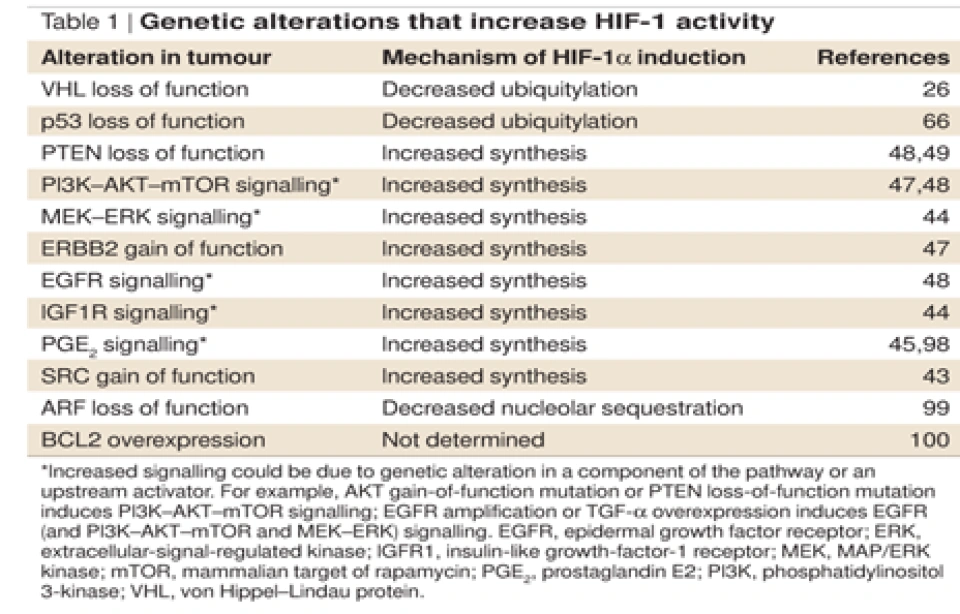
然而,“一个组织中细胞越多,氧气就消耗得越快。当一个细胞分裂成两个时,氧气的消耗将会增加。所以丝毫无需惊讶因生长因子受体的激活而启动转导的增殖和生存信号会诱导HIF-1α表达增加,这也许可被看作是一种在维持氧气平衡的需要的驱动下采取的先发制人操作。”(Semenza, 2003)增殖中的细胞因为氧不足与需氧量大的矛盾,一方面会倾向于依赖糖酵解途径而非氧化代谢途径产生ATP,另一方面表达血管内皮生长因子(vascular endothelial growth factor, VEGF)来而刺激血管的形成,当有血液灌注进来时,细胞密集的组织就会获得生存物质。除了VEGF之外,诸如胰岛素样生长因子2(insulin-like growth factor 2, IGF-2)、转化生长因子α(transforming growth factor α, TGF-α)这样的生长因子,不但可以通过上面说到的非氧依赖途径引起HIF-1α浓度增加,从而使HIF-1浓度增加,后者进入细胞核激活转录的基因中,又包含血管内皮生长因子、胰岛素样生长因子2和转化生长因子α的基因。也就是说,两者之间可以形成正反馈效应。在正常的氧含量下,我们突变VHL等与HIF-1α降解有关的基因导致HIF-1α降解障碍,由于HIF-1可以激活一揽子生长因子的表达,因此它将成为癌症的导火索。但是不是因为这些生长因子会引发致癌突变,一方面,这些生长因子促进增殖分裂,而每一次分裂都会产生错误,增加分裂次数就相当于积累产生错误的机会;另一方面,由于蛋白质合成、复制进程等加快了,错误发生的概率也增加了。在正常情况下,HIF-1的异常激活,会产生促癌促肿瘤的效应。比如,如果冯·希佩尔-林道蛋白发生失活突变的情况,那么就会引发冯·希佩尔-林道病(von Hippel-Lindau disease)。
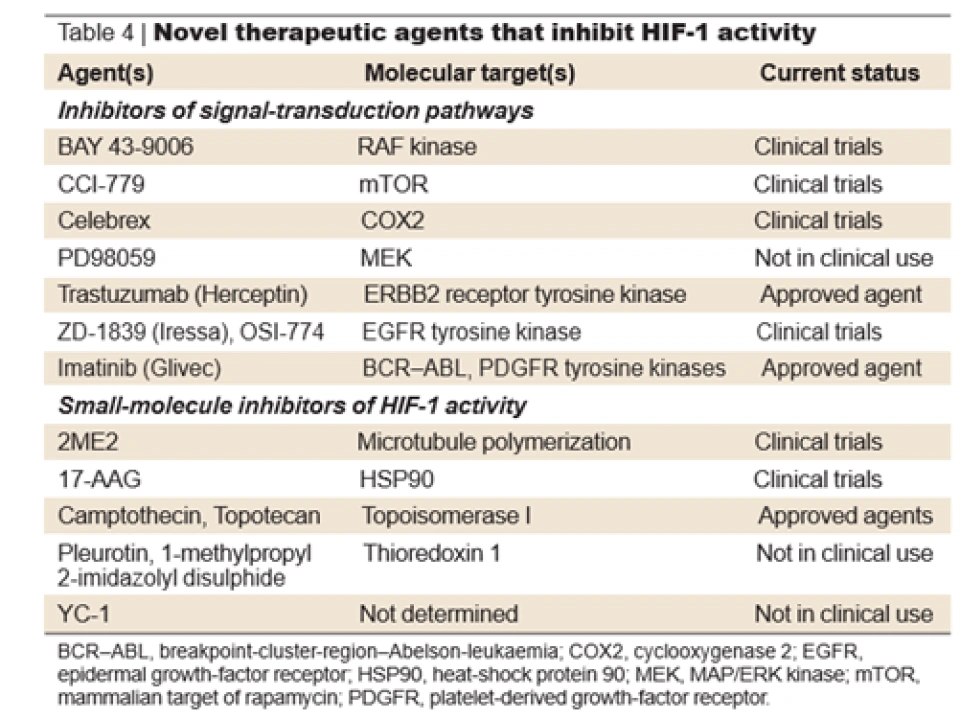
冯·希佩尔-林道病是一种罕见的常显的遗传病,临床表现为全身到处长血管肿瘤和癌症,包括血管母细胞瘤、肾脏血管瘤、肾细胞癌以及嗜铬细胞瘤等等。德国眼科医生尤金·冯·希佩尔(Eugen von Hippel)在1904年第一个描述了眼球内血管瘤的病例;艾维德·林道(Arvid Lindau)在1927年描述了小脑及脊髓内血管瘤的病例。疾病也因此用两人的姓氏命名。凯林和拉特克利夫研究了这种病,从而发现这种病背后的基因VHL,并揭示了它调控HIF-1水平的机制,从而成为了2019年诺贝尔生理学或医学奖的其中两位获得者。HIF-1对于一些癌症来说太重要了。但这也意味着如果我们抑制它——因为在正常的机体内和正常的氧含量时HIF-1是几乎不存在于细胞内的——所以HIF-1正在成为一种新的治疗癌症的药物靶标,并且在未来,针对它的疗法可能成为最有效的疗法之一。值得大家注意的是,科学家不仅致力于开发出直接抑制HIF-1的药物,还在致力于开发针对与之相关的蛋白质和途径的道路。
从上面我们可以看到,HIF-1可以说是一把双刃剑。它对胚胎发育、氧平衡等过程至关重要,但同时却又会成为促进癌症发生、增殖和转移的关键导火索。这一方面是它进化出这么一个古怪的调控方式:需要时迅速产生,不需要时立刻分解的根本原因,另一方面也是三位科学家——威廉·凯林、彼得·拉特克利夫和格雷格·赛门扎获得今年的诺贝尔生理学或医学奖的外在原因。不过,三位科学家将会继续进行他们的研究,因为关于HIF这类物质还有很多疑点没有搞清楚,它甚至可能不是唯一的氧平衡途径。更重要的是,对它的研究将把我们对氧平衡的理解,以及新的疾病疗法乃至整个医学的进展往前推进一大步,它对人类的价值将是不可估量的。
Key publications & Referecences:
Semenza, G.L, Nejfelt, M.K., Chi, S.M. & Antonarakis, S.E. (1991). Hypoxia-inducible nuclear factors bind to an enhancer element located 3’ to the human erythropoietin gene. Proc Natl Acad Sci USA, 88, 5680-5684
Wang, G.L., Jiang, B.-H., Rue, E.A. & Semenza, G.L. (1995). Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci USA, 92, 5510-5514
Maxwell, P.H., Wiesener, M.S., Chang, G.-W., Clifford, S.C., Vaux, E.C., Cockman, M.E., Wykoff, C.C., Pugh, C.W., Maher, E.R. & Ratcliffe, P.J. (1999). The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature, 399, 271-275
Mircea, I., Kondo, K., Yang, H., Kim, W., Valiando, J., Ohh, M., Salic, A., Asara, J.M., Lane, W.S. & Kaelin Jr., W.G. (2001) HIFa targeted for VHL-mediated destruction by proline hydroxylation: Implications for O2 sensing. Science, 292, 464-468
Jakkola, P., Mole, D.R., Tian, Y.-M., Wilson, M.I., Gielbert, J., Gaskell, S.J., von Kriegsheim, A., Heberstreit, H.F., Mukherji, M., Schofield, C.J., Maxwell, P.H., Pugh, C.W. & Ratcliffe, P.J. (2001). Targeting of HIF-a to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science, 292, 468-472
Figure origins:
第14面:Semenza, G. L. (2003). Targeting HIF-1 for cancer therapy. Nature Reviews Cancer, 3(10), 721–732. doi:10.1038/nrc1187
第15面上:作者自己用ChemDraw绘制
第15面下:杨蓉, 潘建伟, 朱睦元. 真核生物翻译起始机制[J]. 遗传, 1999(05):67-70.
第16面:维基百科
第19面上、中、下:来自网络
第21面上:网络
第21面下:Jawahar L. Mehta, Naranjan S. Dhalla. Biochemical Basis and Therapeutic Implications of Angiogenesis[J]. 2013.,p98
第22面下:Semenza, G. L. (2003). Targeting HIF-1 for cancer therapy. Nature Reviews Cancer, 3(10), 721–732. doi:10.1038/nrc1187
第23面:Ibid.
















奖励金币:10
奖励理由:内容丰富饱满
①字体不宜太大17号最佳
②首行不用空两格
③行间距为2最佳
④段落之间空一行(或者设置段前距离20)会更美观
⑤文中标题上下空一行(或者设置段前距20和段后距20)会更美观
⑥可搭配利用居中,颜色等
⑦参考来源注释等可使用15号字体,颜色灰色等搭配使用,效果更佳
还有更多排行功能和格式
可以在发表后,用手机打开自己看一下行文是否舒适美观,然后再进行修改,可以多次修改达到最佳阅读体验