科普驿站 第六十二期
主题:化学与可持续发展
科目:化学
难度: A2
讲师:北砜
写在前面:
我是知识的搬运工,分享我获得的知识,如果文案内容有什么学术性错误的地方请积极指出,方便我纠正错误。如果是言论和观点上的分歧,欢迎与我私下交流,我不接受任何非学术性质问题的抬杠和诋毁。
在看我的科普的时候希望大家保持理性思维,不是要知道是什么,而是要知道为什么。我将带你用化学家的视角看待环境问题,从微观角度分析环境问题的产生原因。一切的自然现象背后,都是物质相互作用的结果。
正文:
自18世纪工业革命以来,人类社会的生产力得到了空前的发展,随着技术的进步,人类生活的舒适度也不断提高。然而,人口剧增,资源的过度开采,废物的不断排放使大自然无法承受如此沉重的负荷,由此导致了生态平衡破坏、生物多样性锐减、全球气候变暖、臭氧层空洞、酸雨及水体污染、土地沙漠化等一系列后果……
大自然对人类的报复也越来越频繁,越来越剧烈,人类面临着严峻的挑战。
“环境与发展”已经成为人类共同关心的话题。
下面我会按照圈层来介绍我们所面临的环境污染。
1.大气
大气中的物质按物理状态分类有气体、液体和固体。气凝胶是指分散系直径大小为10-9-10-5 m的颗粒或液滴。颗粒指尺寸大于10-5 m的粒子。正常的大气中含有极微量的污染气体,例如CO含量1.0 mg/m3,SO2含量0.15 mg/ m3,氮氧化物(以NO2计)含量0.15 mg/m3,这些污染物的“本底浓度”(指大气或水体中某物质基本混合均匀后的浓度,也称为背景浓度)很低,对人及其他生物、设施不会构成危害。但随着工业发展、汽车普及以及人类的其他各种活动增加,不仅大大增加了大气中上述污染物的含量,还引入碳氢化合物、氟里昂及其他气体,由此导致严重的大气污染。
大气污染按排放过程分类有一次污染物和二次污染物,直接排放出来的污染物为一次污染物,一次污染物经一系列化学反应过程而形成的污染物称二次污染物。按污染物的种类划分,则主要有八类:
(1)含碳化合物: CO与CO2
(2)含硫化合物: SO2 ,SO3 ,H2S, (CH3)2S(甲硫醚),H2SO4
(3)含氮化合物: NO , NO2 ,NH3, HNO3 ,N2O
(4)碳氢化合物及其衍生物(烃类,醛,酮)
(5)光化学氧化剂: O3 ,PAN(指硝酸过氧化乙酰),H2O2
(6)含卤化合物: HF,HCI,CFCl(指氟利昂)
(7)颗粒物:烟尘,H2SO4,雾滴,HNO3雾滴,重金属元素
(8)放射性物质
以下分别介绍几种主要的污染物。
(1) CO
含碳物质的不完全燃烧会产生CO,它无色、无味,不溶于水的气体,它和血红蛋白结合的能力比O2强250倍,会抑制血液中的“氧传输”,导致“一氧化碳中毒”。若空气中的CO浓度达到1‰左右,就可使血液中半数的血红蛋白成为一氧化碳血红蛋白,造成人体缺氧、晕眩、恶心、昏迷甚至死亡。自然界中,CO可以被土壤吸收,在微生物的帮助下转化为CO2。
为抑制CO的排放,可以通过改善燃烧装置使空气流通从而保证含碳燃料的充分燃烧,并将燃烧尾气通向室外以避免CO的产生与积累。在汽车行业中,可以改进发动机结构与优化工作状态并安装尾气净化装置以控制尾气排放。汽车尾气净化器实际上是一个催化转化装置,其活性组分为贵金属(如Pd, Pt), 为保证贵金属催化作用的充分发挥,通常将其分散在高比表面的载体如r-Al2O3上,并利用CeO2对r-Al2O3,进行修饰(改变晶格来提高催化性能)。CeO2具有萤石型结构,结构中可以形成氧空位。在贫燃条件下,CeO2很快转化为CeO2-,而释放出氧气,在富氧条件下再可逆地吸氧变为CeO2 ,具有“储氧”功能,从而保证CO的转化。在催化剂的作用下,尾气中的CO、NO、碳氢化合物,发生如下化学反应:
催化反应后尾气中CO、CXHY和NO的含量大大降低,这类催化剂又称为“三元催化剂”。
(2) SO2
主要源于含硫煤炭的燃烧。它是一种还原性气体,无色,有刺激性气味,对植物有漂白的作用。
SO2在空气中存在时间较短,它可以附着在空气中的漂浮的微粒上,在光照下与氧气发生反应转化为SO3,SO3与水反应而转化为H2SO4从而形成酸雾。因此,要控制SO2的排放,减轻危害。以往采取高空排放,以避免SO2在低空积聚而对人类和其他生物产生强危害。但要从根本上解决问题,应该控制SO2的产生,例如煤使用之前要经过筛分以除去含硫矿物;在烧煤的炉膛中添加石灰石(CaCO3)、白云石粉(CaCO3、MgCO3),燃烧过程中CaCO3受热分解出CaO,CaO与SO2作用而形成炉渣亚硫酸钙(CaSO3);燃烧产生的烟气再进行湿法或干法脱硫。湿法脱硫是用石灰水等碱溶液吸收烟气中的SO2 ,干法则利用活性炭或磺化煤吸附有害气体。
(3) NXOY(氮氧化物)
为含氮氧化物N2O、NO、NOX等的总称。危害严重的污染物主要是NO和NO2。NO为无色无味的活泼气体,和血液中血红蛋白的结合能力比CO还强,会造成血液缺氧而引起中枢神经麻痹。NO2是一种棕红色窒息性气体,毒性高于NO,它有特殊的刺激性臭味,对呼吸道和肺部有严重的刺激作用,能引起支气管哮喘、肺水肿等疾病。NOX对心、肝、肾造血系统也能造成损害。NO的来源有三条途径:
(1)空气中的氮或燃料中的氮在燃烧过程中与氧气反应,N2+O2产生NO的过程为吸热反应,燃烧的温度越高,生成的NO越多(高中常客);
(2)制造和大量使用硝酸的工厂,在生产和使用过程中,排出大量含有氮氧化物的废气;
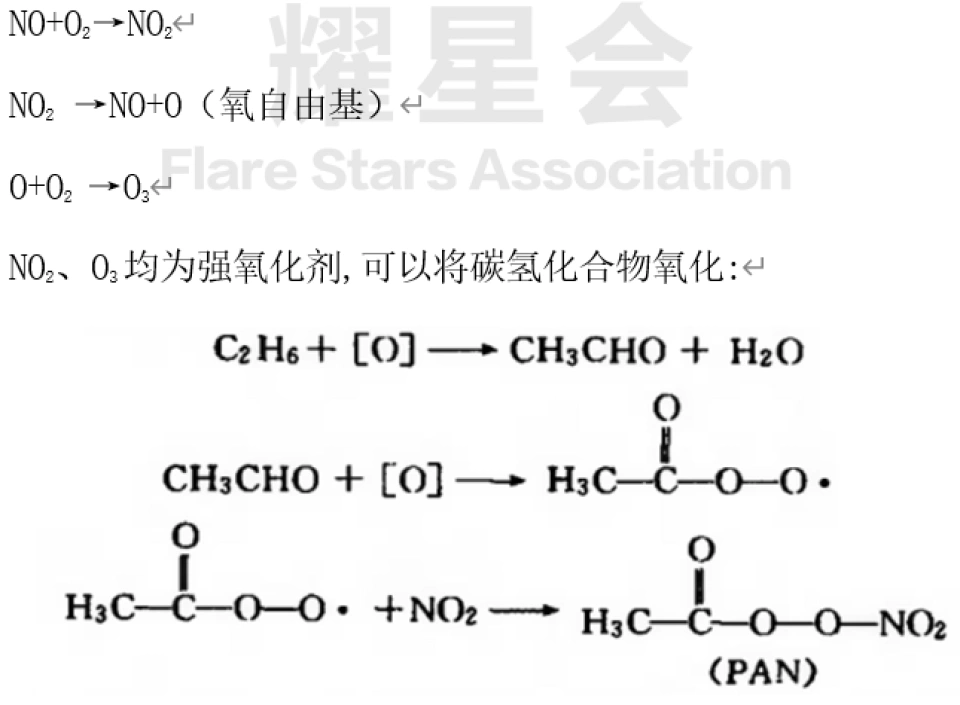
(3)城市中NOx主要来源于汽车尾气。汽车尾气中又以NO为主,NO遇O2即转化为NO2 ,NO2为光化学烟雾的主要组分。以下为相关反应式:
PAN,即硝酸过氧化乙酰,又称过氧乙酰硝酸酯,是一种致癌物。O3和PAN为光化学烟雾中的二次污染物。NOX的消除相对难一些,在用碱液吸收除去85%SO2的条件下,NO,只能除去5%-15%。目前采取的主要还是贵金属催化还原法,使NOX分解或与还原剂(如NH3)反应,生成N2。
(4)碳氢化合物及其衍生物
碳氢化合物可以是烷烃、烯烃、芳香烃等等,C原子数可以是1至多个,甚至几百个。主要源于煤、石油等燃料的不完全燃烧过程或者溶剂油、煤油、汽油、柴油等液体的泄漏。
苯与甲苯是许多加工业中常用的溶剂,会诱发神经中毒、白血病等疾病。烃类在空气中可进一步被氧化为醛、酮乃至PAN,产生次级污染。烟雾、烤制食品过程还可能有a苯并芘产生,它是一种多环芳烃,会诱发癌症。
(5)氟里昂(Freon)
氟里昂是–种商品名,指氟氯代烃。为使取代烃的性质如沸点满足要求,常常进行氟与氯共取代,因此,它是多种氟氯代甲烷、乙烷、丙烷的总称,英文代号为CFC。氟里昂化学性质稳定,不可燃而且对生物“无害”,因而被广泛用做制冷剂、发泡剂、溶剂等。然而,当氟里昂进入高层大气,在紫外线照射下,可以发生解离形成自由基(Cl·,具有极高的反应活性) (氯自由基),可进一步与O3发生反应:
每一个Cl(氯自由基)可消耗10万个O3分子,从而导致臭氧层破坏。
(6)大气中的悬浮颗粒
除气体污染外.大气中的悬浮颗粒和气凝胶也会造成污染。大量吸入微粒可能会引发哮喘、肺气肿等疾病,沉降后使植物蒙尘,阻碍光合作用,也可能导致电路接触不良或引发短路,引起机械装置损坏。
微粒一般可以自行沉降。气凝胶则可以长时间地分布在大气中。它尺寸小,比表面大,有强烈的吸附作用。气凝胶是各种天气现象如云、雨、霞光等发生的重要因素,也可以成为污染物的载体,许多污染气体得助于气凝胶表面而发生转化形成二次污染物。它可以吸附水汽而形成水相,随着呼吸进入人体而引起组织破环。空气中颗粒物来源于自然和人工两大因素,自然因素有:火山喷发、沙漠扬尘、植物花粉传播等过程,而人工因素有:工业过程(沙石、烟尘)、农业过程(喷洒农药、施用化肥)、露天燃烧等。为防止颗粒物的产生,一方面要保护森林和植被,减少自然危害如沙尘暴的发生,另一方面要合理控制人类活动过程,减少排放。例如可以加装离心分离、过滤、喷雾、超声波及静电装置以除去各种颗粒物。
2.水圈
水是滋养生命的摇篮,动物、植物及各种微生物的生存和繁衍都离不开水。水也是一种良好的溶剂,流过岩石,冲刷大地,可以溶解各种各样的物质。千百万年以来,人类汲取大自然所提供的甘洌的清水而生息。老子有云:“上善若水,水善利万物而不争”。然而,随着人类社会的发展,特别是城市的形成和壮大及工业技术的发展和应用,自然界的水资源也受到极大的污染和破坏。水资源枯渴,水体污染,水体发黑变臭、有毒废物滥排乱放,已经成为摆在人类面前的严峻问题。
1.水体的状况及其污染
在地球上.水资源看起来极为丰富。地球的表面积约有5. 1x1014m2 ,其中海洋约有3.6x1014m2 ,占地球表面积的71%。地球上的水总量约有1.36×1018 立方米,其中96.7%的水集中在海洋里,虽然海洋是无比巨大的天然水库,拥有极多的水资源,但目前还很难大规模、低成本地利用。而大陆上所有淡水资源总储量只占地球上总水量的3.3%,这3.3%里约85%是人类难以利用的两极冰盖、高山冰川和冰冻地带的冰雪。人类真正能够利用的是江河湖泊以及地下水中的一部分,仅约占地球总水量的0. 26%。
自然界的水通过蒸发凝结、降水、渗透和径流等作用,不断进行着循环。水体具有自我净化污染物的能力,污染物在水中的浓度可自然地降低,即“自净作用”。河流在流动过程中,可将污染物稀释,使之扩散,这是物理净化过程;污染物在水中发生氧化、还原或分解等化学过程,这称为化学净化;水中微生物对有机污染物的氧化,还原分解的过程则是生物净化作用。当污染物排放到水体中的量太大,自然净化过程不能应付加到水里的物质时就产生了污染。例如,大面积的森林被砍伐,许多草原被开垦,植被破坏,造成降水减少,水土流失甚至沙漠化;又如修堤筑坝,兴修水利,围湖垦荒等,影响到水的正常循环过程;量工业和城市污水的排放,化肥、洗涤剂的使用等等导致水质恶化,产生水污染。
水体污染主要有以下几种类型:
(1)需氧废物:各种动物、植物物料
(2)致病微生物:细菌和病毒
(3)植物养料:硝酸盐,磷酸盐,肥料
(4)有机物:杀虫剂,农药,洗涤剂
(5)其他矿物及无机物:酸、碱、盐(重金属盐,如Hg2+, Cd2+等)
(6)其他类型:废热,石油,放射性物质
2.污染物在水中的作用
(1)流水不腐与生化需氧量
有机物是城市污水、造纸厂废水的重要组分。有机物主要含C、H、O、N、S等元素,它们在水中微生物作用下,可以氧化成简单分子:
上述过程必须有氧的参与,污水中的此类污染物是需氧废物。使一定量水样中有机物质氧化所需要的氧气的量叫做化学需氧(chemical oxygen demand,简称COD) ,而有机物被水中需氧微生物分解所需氧气的量称为生化需氧(biochemical oxygen demand ,简称BOD)。若时间和条件充足,有机物均可以完全氧化而变成CO2、H2O、NO3-和SO4-等简单的无机物。
例题:如果某水样中含0.001%的有机物,若以C6H10O5表示其组成,计算将其氧化所需的氧气量。
水样中有机物含量为0.001%,即1 L水样含0.01g有机物,若按C6H10O5计算:
C6H10O5+ 6O2=6CO2 + 5H2O
162 6×32
0.01g xg
x = 0.012
即要使1L水样中的有机物完全氧化,需要的氧气量为0.012g。20度、101kPa条件下,水的饱和溶解氧量为0.0092gO2/1LH2O。可见,水中有机物氧化所需氧气量还是相当可观的。若O2供应不足,需氧量大于供氧量,则水体中的有机质会发生腐烂。有机物中所含的硫和氮,则在厌氧菌作用下发生分解产生H2S、NH3使水质变臭。
而较大的表面积容许较快地吸收氧,浅而冷的山溪里,水体从空气中吸收氧比温暖而缓慢流动的河湖中快得多,可以及时补充水中所需氧气,这就是所谓“流水不腐”。
化学需氧量(COD)测定: 一定条件下,利用化学氧化剂如高锰酸钾、重铭酸钾等氧化水样中的还原性物质,定量测定所消耗的氧化剂的量,再换算成相应的氧气量,即得水样的化学需氧量,以mg/L表示。化学需氧量越高,表示水中需氧污染物越多。
生化需氧量(BOD)测定:采集指定的水样,向含定量污水样的容器中加入–定体积已知含氧量的NaCl溶液,混合密封,在20摄氏度下保持5天,测定体系中的剩氽氧气量,计算所消耗氧气量,即得生化耗氧量。按此方法测得的生化耗氧量以(BOD)s表示:
(BOD)s=消耗氧气的量(mg)/试样的体积(L)
根据BOD值的不同可以了解水中需氧废物的情况。
(2) DDT的功与过
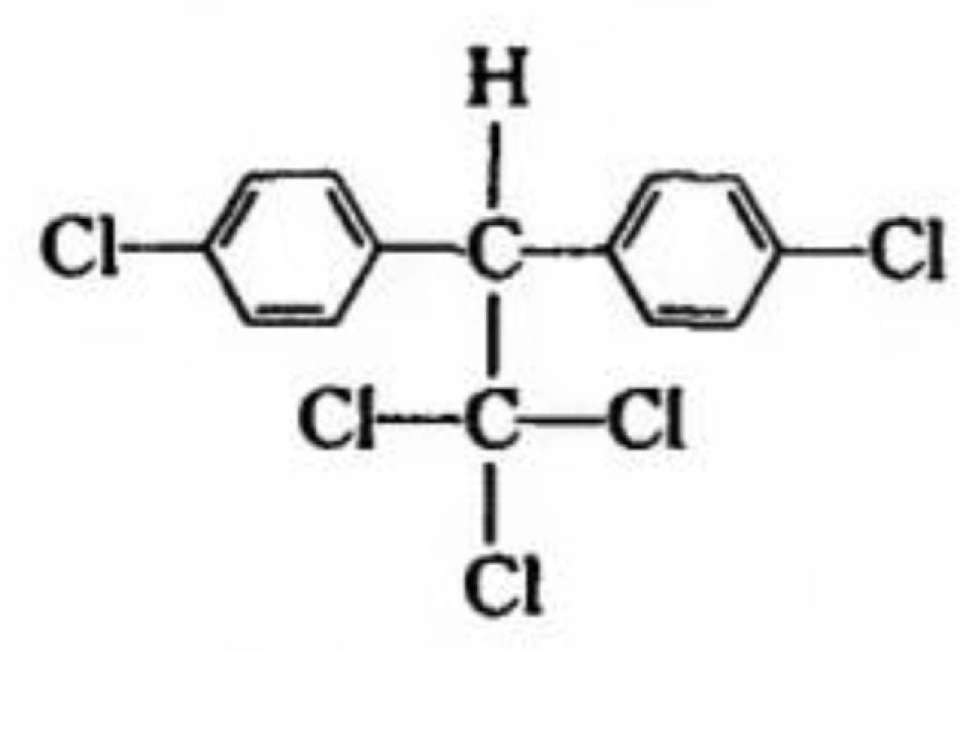
1962年,美国科学家Rachel Carson女士的著作——《寂静的春天》一书出版。书中描述了一幅凄凉的景象: DDT等杀虫剂的使用导致鸟类灭绝,春天失去了鸟儿的歌唱,死一般的沉寂。DDT 的化学名称为2,2双(对氯苯基) – 1,1,1-三氯代乙烷,其结构式如下:
1939年瑞士化学家Paul Muller发现DDT是一种对昆虫有效的神经性毒剂,而对人畜毒性较小。因此,在第二次世界大战期间,DDT大量喷洒,以对抗黄热病、斑疹伤寒、丝虫病等虫媒传染病。DDT灭蚊效果特别显著,蚊子的消灭又使全球疟疾的发病得到了有效的控制,挽救了成千上万人的生命。为此,1948年Paul Muller获得诺贝尔医学奖。战后,DDT作为农药用于农林业,使病虫害得到控制,农作物产量增长。到1962年,全球疟疾的发病已降到很低,世界各国响应世界卫生组织的建议,在当年的世界卫生日发行了世界联合抗疟疾文件,DDT备受推崇。恰逢此时出版的《寂静的春天》引起很大反响,在争议和指责的声浪中,人类不得不面对DDT及其他杀虫剂使用带来的严峻的环境破坏问题。
DDT 水溶性差,稳定性好,不易降解,在自然界的生物半衰期为8年。上述特点一度显示出有效控制病虫害的优势。然而,使用十几年之后,一方面,有些昆虫对DDT产生抗药性,另一方面,DDT在自然界进入食物链,由于其脂溶性良好而在动物体内富集。监测表明,在美国长岛的水域中,小鲦鱼体内DDT含量为0.04ug/g,大鱼中为1 ug/g,而海鸥体内则高达75 ug/g。由于氯化烃会干扰鸟类体内钙的代谢过程,导致鸟类的蛋壳变薄,使其无法正常繁殖,游隼、秃头鹰和鱼鹰数量锐减。杀虫剂甚至可以进入到人和动物的生殖细胞里,破坏或者改变遗传物质DNA。基于此20世纪70年代以来,许多国家立法禁止使用DDT等有机氯杀虫剂。2001 年5月,世界127个国家和地区签署了《斯德哥尔摩公约》,在全世界禁止或限制使用12种持续性有机污染物,其中包括8种有机氯杀虫剂,4种其他有机氯化合物。目前尚未找到一种经济有效且对环境危害小的、可替代DDT的杀虫剂,疟疾开始在某些地区卷土重来,需要引起警惕。
我们下期继续介绍
【本文为耀星会的原创作品,未经允许,禁止盗用、转载、篡改文章,否则耀星会和作者将追究版权责任。】
更多科普资源和答疑,请加入耀星会科普官方QQ群:433646418

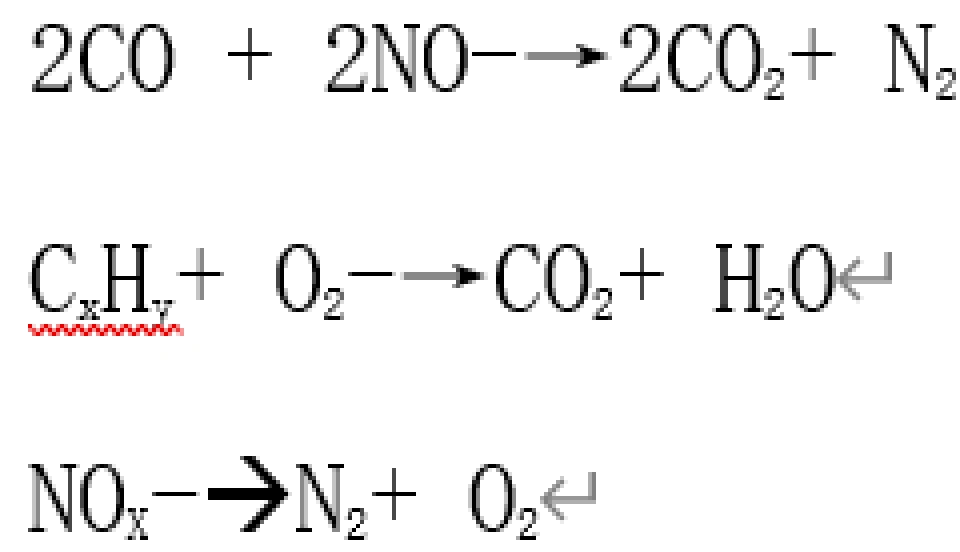
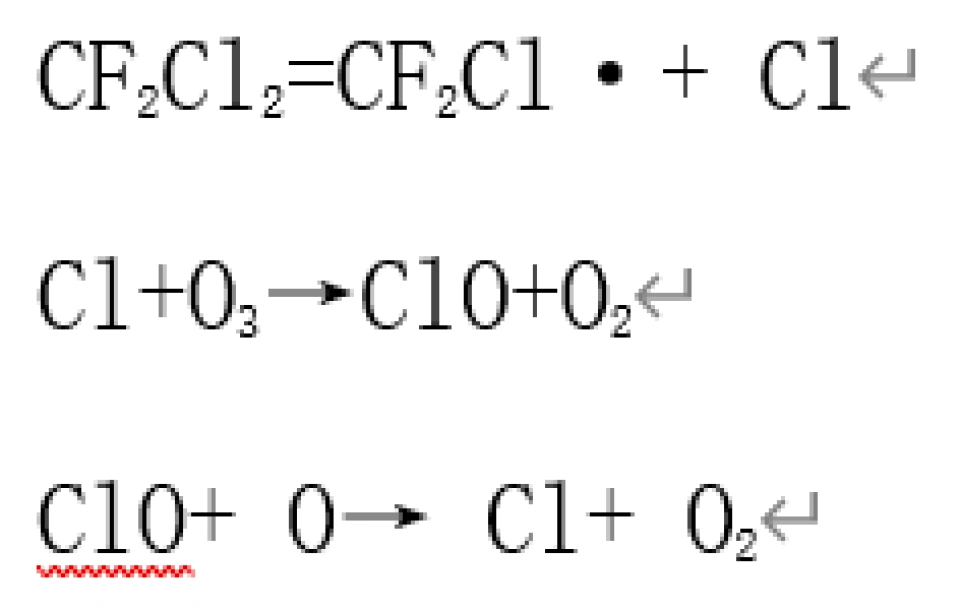
















看前红包好习惯