科普驿站 第二十四期
科目:生物
难度:B2
讲2-10.13师:杜瑾鸿
2019年10月7日,诺贝尔生理学或医学奖揭晓了。获奖的三位科学家分别是威廉·凯林(William G. Kaelin Jr)、彼得·拉特克利夫(Sir Peter J. Ratcliffe)与格雷格·赛门扎(Gregg L. Semenza),而这是为了表彰他们“发现了细胞如何感知和适应氧气供应”。
自此,我们对细胞呼吸、增殖等功能调节的全新理解的探索历程便即将以一段绵长的低音走向尾声了。在细胞的氧平衡中扮演核心角色的正是一种名叫HIF-1的蛋白质,这也正是三位科学家的工作核心。HIF-1如何扮演自己的核心角色——将成为本文的主要内容。
HIF-1的发现
回到大约90年代上下,赛门扎刚在约翰-霍普金斯大学就读博士后,有了自己的实验室,他开始用肝癌细胞进行实验。有一次他发现,当使肝癌细胞处在1%的低氧含量环境中时,细胞内的促红细胞生成素(Erythropoietin, EPO)的转录产物(相当于mRNA)的含量暴增了接近50倍,但用蛋白质合成抑制剂可以阻断这种增加。这并不是第一次有人做出来这个结果,1986年邦杜兰特(Bondurant)与库里(Koury)两位科学家的团队也曾发现,在缺氧条件下,促红细胞生成素的表达量会突然升高。
促红细胞生成素又叫红细胞刺激因子、促红素,这种肽类(糖蛋白类)激素早在1953年就被发现了。它的基因位于7号染色体。它刚被合成出来的时候,有193个氨基酸,但成熟的形式与之相比,被切去了一个27肽,所以它最后有166个氨基酸,分子量18398,有4个二硫键。它的最主要功能——窥其大名就能一清二楚。如果血液中这种物质一直处在高浓度水平(无论是细胞产生的还是人为地注射),人的红细胞就会增加,血液从而将能携带更多氧气。它主要是在肾脏分泌的,不过不属于内分泌腺的细胞也能表达这种糖蛋白。EPO是通过EPO受体(或者缩写成“EPOR”)来发挥作用的。而除了红细胞那一系的一些细胞能表达EPOR之外,内皮细胞、神经元、心肌细胞等等也都能表达EPO受体。事实上EPO还有抗凋亡和促进细胞生存的作用。
上面的实验证据表明,缺氧能够显著升高EPO的转录产物的水平。很显然这是有什么物质作用于EPO的基因上。那到底是什么呢?
赛门扎开始分析EPO的基因。我们都知道,基因是有遗传效应的DNA片段。除了编码蛋白质的DNA片段之外,一个基因的周围还有很多对它的表达水平有调节作用的DNA片段。他做了一系列基因操作来研究EPO附近哪些片段对这个基因的表达有调控作用。1991年他得出了一个关键的结论,即在染色体上EPO基因这个片段的附近有一小段DNA,这小段DNA能够与一些在肝细胞和肾细胞中因为贫血等原因而被激活的细胞核蛋白质结合,从而引发缺氧诱导的EPO基因转录。几乎在同一年,拉特克利夫的团队也公布了他们通过实验得出的结论:一个位于EPO基因旁边的很小的DNA片段(他们称之为“元件”)有高度的嫌疑是EPO缺氧诱导效应作用的关键区域。他们同样是用肝癌细胞做的研究。
这个小片段被赛门扎称为缺氧反应元件(hypoxia response element),1992年,在赛门扎和他实验室里的另外一位博士后——王广良的努力下,这个片段的范围被缩小到了50个碱基以内。(今天,我们已经知道,它很简单,只有5-6个脱氧核苷酸即5’-RCGT(S)C-3’,位于EPO的增强子内。)他们找到了一些可以与这段DNA特异性结合的蛋白质。结果表明,在这些蛋白质中,有一种只有在缺氧的时候才会大量产生,于是他们就把这个蛋白质命名为缺氧诱导因子(hypoxia-inducible factor, HIF)。
赛门扎和拉特克利夫都发现,这种蛋白质能刺激很多细胞(不只是局限于肝癌细胞和肾脏细胞)表达促红细胞生成素(EPO)。这开始让科学家们产生了这样一种想法:他们很可能首次发现了细胞对氧气水平的探测和应激系统的重要一环。细胞需要对氧气水平保持敏感,这在当时是推测,现在已经被证实了。类似的现象科学家还观察到了很多,例如有人发现高海拔地区常居人群的促红细胞生成素表达量比低海拔地区常居人群高。在当时有一个共识,就是细胞自进化出多细胞体系开始,就面对着氧气含量大幅度的变化,所以细胞里肯定存在一整套非常完善的感应机器。这意味着如果我们要把它搞清楚,就要耗费大量的工作。而赛门扎这一次,很可能找到了这个庞大机器的一个枢纽。科学家觉得HIF扮演的角色很有意思,因为他们发现缺氧诱导因子并不只是在之前研究的细胞中表达,而是会在缺氧时存在于几乎每一种细胞中,这个发现引起了更多科学家的注意。赛门扎和拉特克利夫的团队由此开始壮大起来。
王广良利用凝胶电泳的方法,提取并纯化了这种蛋白质。他发现这个缺氧诱导因子是一个异源二聚体——就是两个不同的蛋白质拼起来,成为一个复合体。其中一个被命名为HIF-1α,另外一个被命名为HIF-1β。后来经过更深层次的研究HIF-1β又被命名为芳香烃受体核转运因子,缩写为ARNT1。实际上它可以与很多蛋白质形成异源二聚体。人们已经确定它对氧气含量的变化并不敏感,所以主角就自然落到了HIF-1α的头上。
HIF-1的结构和表达
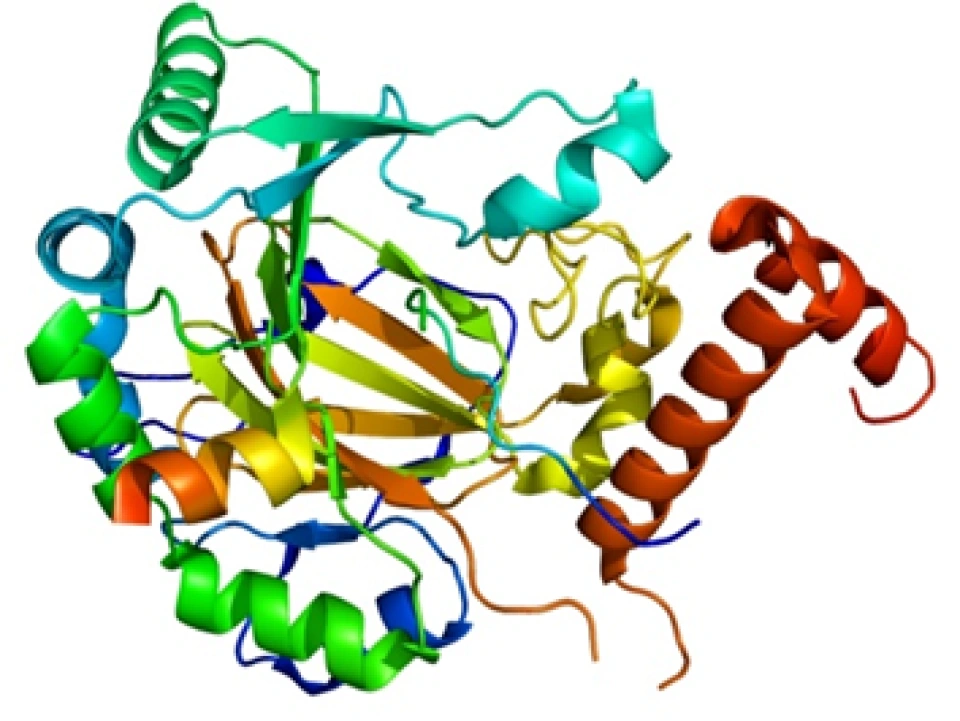
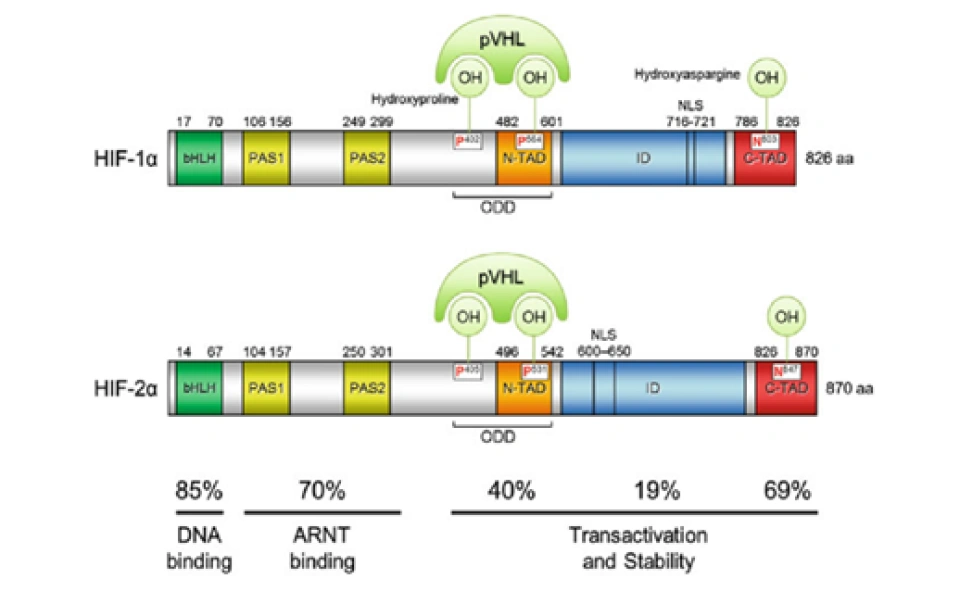
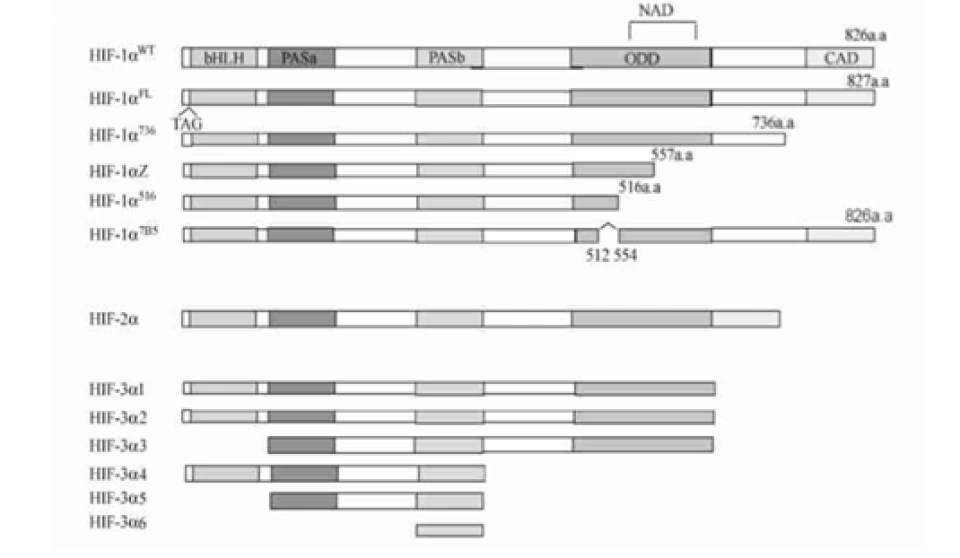
HIF-1α正是HIF-1的「活性亚基」——即HIF-1发挥功能(活性)的主要部分。它的分子量大约12万,基因位于14号染色体,其外显子编码826个氨基酸,它的空间结构模式图如图所示。
HIF-1β又称芳香烃受体核转运因子(aryl hydrocarbon receptor nuclear translocator, ARNT),分子量是91000-94000。它的基因位于1号染色体。由于它的基因中有一个编码15个氨基酸的可变外显子。即便是外显子,也可能在剪接的时候被剪掉,因此,HIF-1β有两种可能的存在形式,一种含有789个氨基酸,另一种含有774个氨基酸。HIF-1β是正常表达的,因为它还有其他的功能。我们可以从它的别名推测它的其他功能。芳香烃受体(AHR):虽然它是一个受体,但是它存在于细胞质基质中,并且与热休克蛋白90(Hsp90)和其他多个蛋白质结合在一起。当它与一些配体如二恶英(一种可怕的环境污染物)结合的时候,就会与Hsp90分离,然后结合ARNT并进入细胞核发挥它的功能。现在已经发现了六七种芳香烃受体。
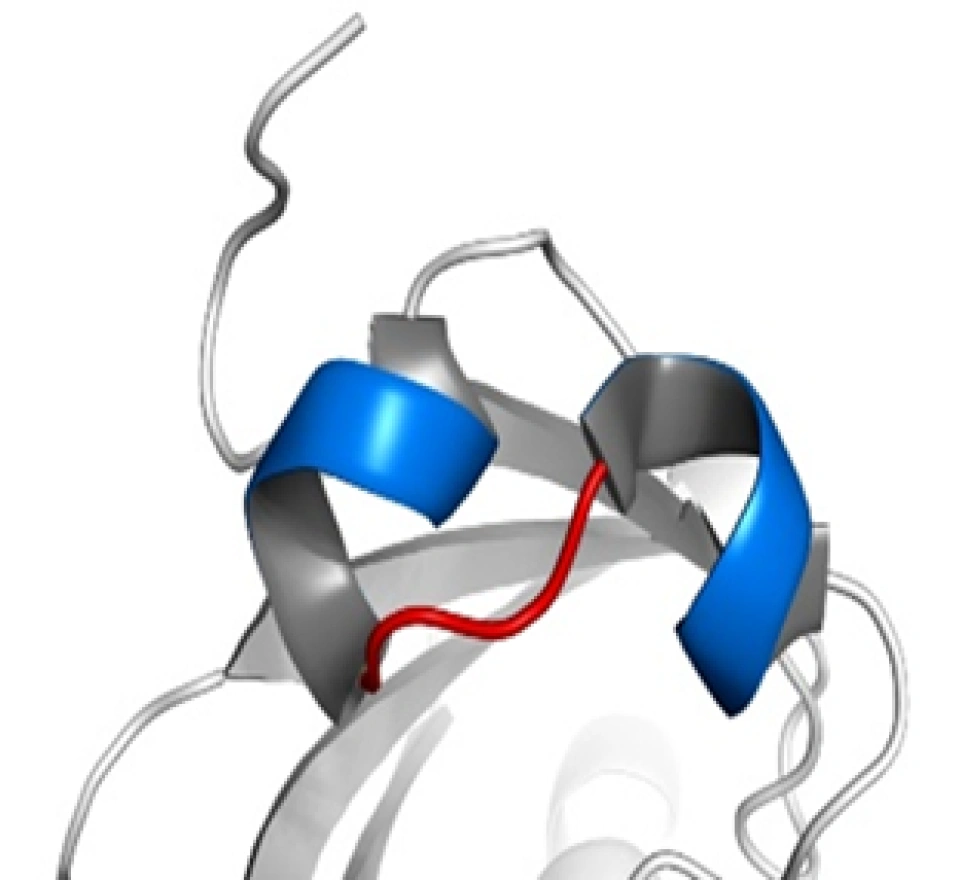
HIF-1α、HIF-1β和所有的芳香烃受体都有两个关键的结构域:碱性螺旋-环-螺旋(basic helix-loop-helix, bHLH)结构(如图所示,蓝色为螺旋的部分,红色为环的部分)和PAS(Per/Arnt/Sim,分别是periodicity, ARNT, single-minded的缩写)结构域。其中PAS结构域有两种,即PAS-A和PAS-B。(这两种结构域的具体结构大家可以自行了解,这里将不再介绍。它们在很多蛋白质中都存在,以至于可以整理出一个蛋白质的“家族”,这个家族中的成员,都具有这种结构域,然后这个蛋白质家族还可以以这种结构域的名字命名——“XX结构域”包含(-containing)蛋白、“XX结构域”家族、“XX结构域”蛋白……——没错,如果你没有这种尿性的觉悟,命名蛋白质可能对你来说是件困难事。)它们属于bHLH超家族下的PAS亚家族。那么在这个家族中还有哪些成员呢?下面列举几个,如:
果蝇生长发育因子Trachealess;
21-三体综合征临界因子;
果蝇神经细胞发育调节因子SIM(single-minded);
TIF-2、核受体共活化物 ACTR(Actin-related protein,肌动蛋白相关因子)和几种生物钟蛋白质等等。
(好了,作者知道这些名字你都没听过,所以让我们pass。)
这个结构域主要就是为蛋白质之间两两结合(尤其是形成二聚体)而服务的。
现在回到HIF-1α。它还有很多重要的结构域,如图所示。
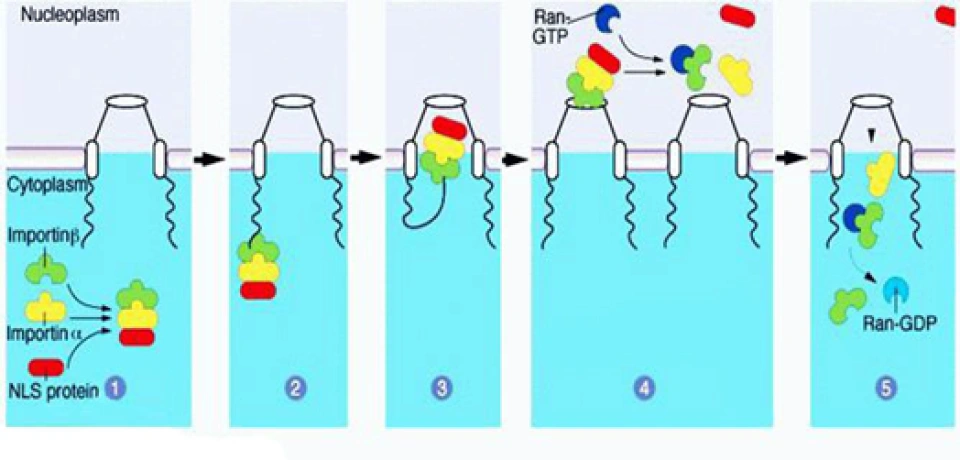
其中一个是“氧气依赖的降解”(oxygen-dependent degradation, ODD)的结构域,位于HIF-1α肽链的游离羧基端(C端);还有两个反式激活结构域(transactivation domain, TAD),一个在ODD附近(换言之即靠近C端),称作TAD-C(或者叫做CAD、C-TAD);一个更加靠近游离氨基端(N端),称作TAD-N(或者叫NAD、N-TAD)。这两个结构域是HIF-1α起始和刺激靶基因转录所需的部分。TAD-C与TAD-N之间还有一个抑制结构域(inhibitory domain, ID),能够降低HIF-1α的转录激活结构域的活性。此外,还有一个对它进入细胞核至关重要的核定位信号(nuclear localization signal, NLS),其氨基酸排列方式是RKRKMEHDGSLFQAVGIGTLLQQPDDHAATTSLSWKR。一个将蛋白质送进细胞核的方法是是通过核孔(如下图所示)。
蛋白质的空间结构中核定位信号的部分会与细胞核外的内输蛋白α1(importin α1,又叫核转运蛋白60p(karyopherin 60,Kap60)或Kapα2)结合;同时内输蛋白β1(又叫Karyopherin 95p, Kap95p或者Kapβ1)也与内输蛋白α1结合在一起,加强前两者之间的亲和力,这样形成了“转运复合物”。然后内输蛋白β与核孔复合体的胞质纤丝结合,核孔复合体随即发生构象改变,将转运复合物转移至核内。随后转运复合物与Ran-GTP(Ran还有一个名字叫做“GTP结合核蛋白”,这种物质是由Ran与GTP结合而成的。Ran也有GTP酶的活性,可以水解GTP。)结合,从而导致复合物解离,被转运的蛋白被释放。此后,内输蛋白α/β与同它们结合的Ran-GTP返回细胞质,在细胞质内,经由Ran结合蛋白1(Ran binding protein 1)和Ran GTP酶激活蛋白(Ran GTPase activating protein, RGAP)的作用,Ran-GTP水解成Ran-GDP从而与内输蛋白分离。之后Ran-GDP再返回细胞核内,重新合成为Ran-GTP。如果是核内蛋白出细胞核的话,就要由外输蛋白(exportin)来介导,相关的信号序列叫做核输出信号(nuclear export signal, NES)。既有NLS又有NES的蛋白质则既能够进入细胞核,也能够出细胞核,并且都是通过核孔复合体并消耗能量来实现的。
后来,科学家又发现了HIF-2α(又叫内皮PAS结构域蛋白(endothelial PAS domain protein 1,EPAS1)),它有869个氨基酸,也含有bHLH、PAS结构域,也能与HIF-1β形成异源二聚体,形成的二聚体叫做HIF-2。但HIF-2α并不是在所有细胞都表达的。人们还发现了HIF-3α蛋白,它的功能人们并不特别清楚,以及还有HIF-2β,抑或ARNT2,等等。很多研究发现它们与HIF-1α有相关性:如果敲低HIF-1α就会下调HIF-3α;HIF-3α在缺氧时可以诱导HIF-1α的表达;HIF-3α能激活HIF-2α:HIF-3α的表达又由HIF-1α和HIF-2α共同促进……人们还发现它的一个剪切变异体IPAS(抑制性PAS结构域蛋白(inhibitory PAS domain protein))能够结合HIF-1α并抑制它的转录调控活性。(刚由转录产生的RNA——或称pre-mRNA(mRNA前体),要经过剪接的过程才能变成真正的mRNA。最终会变成mRNA的部分称为外显子。剪接的过程由细胞核内的剪接体来完成,这是一个有上百个蛋白质和5个RNA构成的巨型复合物。不同的剪接方法,会导致成熟的mRNA的碱基排列方式不一样,翻译出来的肽链也不一样。在细胞内,其实HIF-1α和HIF-3α都有很多种剪接异变体,它们的肽链如图所示。)
虽然三种蛋白质的结构高度相似,但表达特性不一,靶基因和靶蛋白似乎更不一样,在细胞和组织中,它们似乎可以协同作用。人们对HIF-3α了解得最少。
HIF-1β在细胞内含量与表达方式是正常的,HIF-1α的表达稍微复杂一些。大气压强和大气氧含量条件下,HIF-1α在体内的水平极端低,以至于检测不到。在体内,这种蛋白质惨兮兮的,一合成出来就立刻被分解了。那么细胞是如何做到缺氧时HIF-1α含量迅速增加的呢?
调节分解HIF-1α的过程
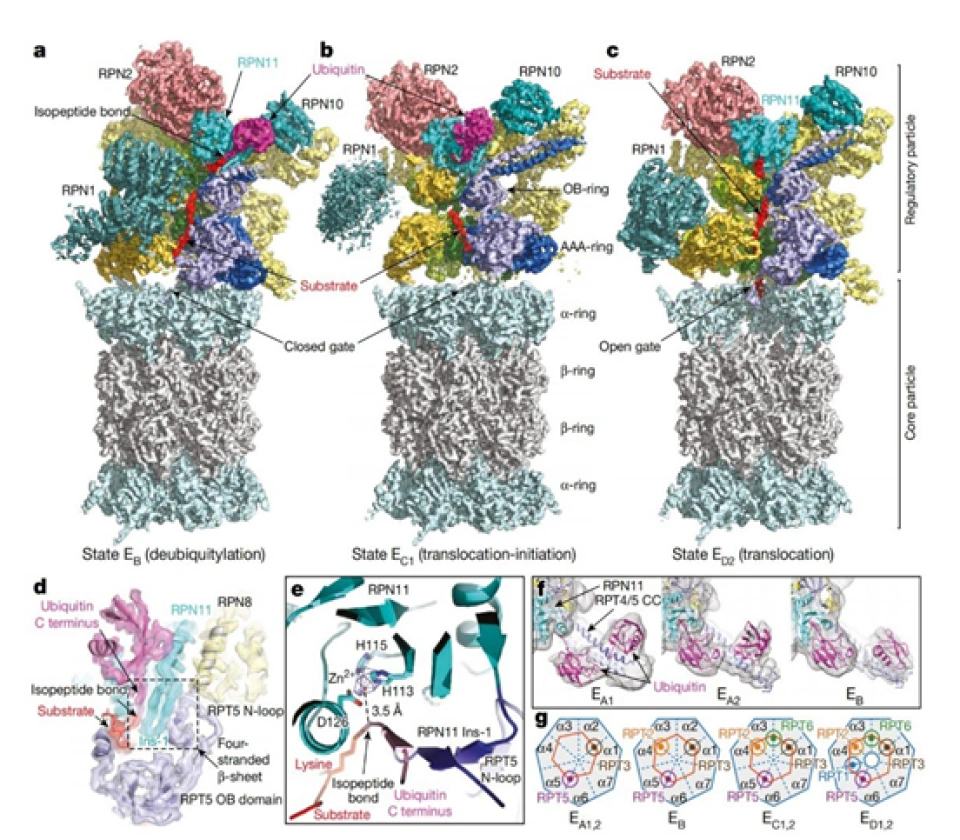
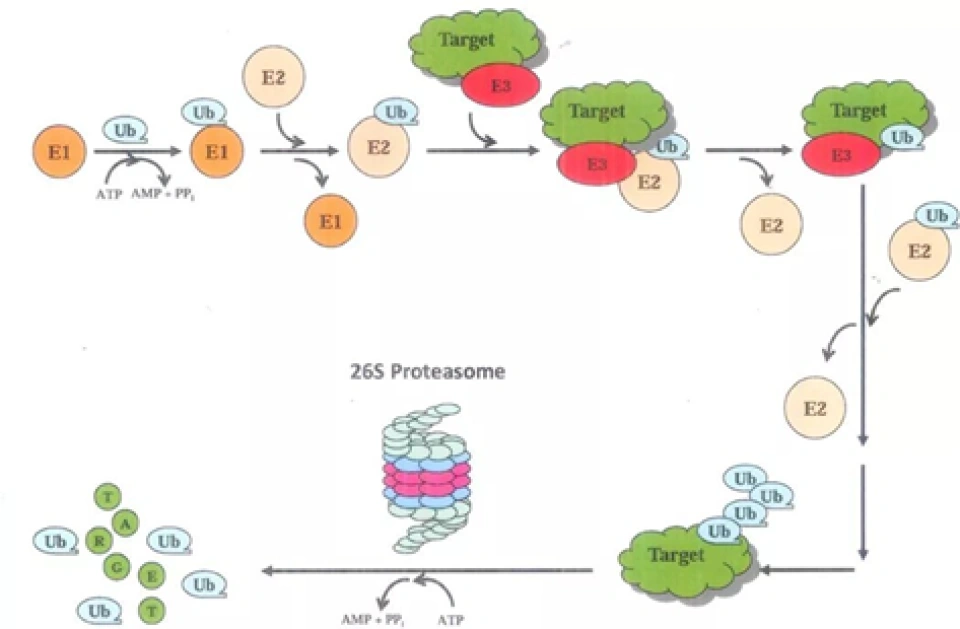
HIF-1α的分解最重要的一种手段就是泛素-蛋白酶体途径。具体来说,就是使HIF-1α与泛素蛋白结合,然后泛素作为信号,使HIF-1α被带到蛋白酶体分解,如图所示。泛素(ubiquitin)是一种蛋白质,它在细胞内本以失活的形式存在,因此如果要将HIF-1α泛素化,还得先把泛素激活。蛋白酶体是细胞内的一种无膜细胞器,它由几十个蛋白质组成。蛋白酶体有多种并且功能多样。这里即将介绍的蛋白酶体是其中一种——26S蛋白酶体。(“26S”是沉降系数,沉降系数表示的是一定条件下进行离心时蛋白质的沉降速度。S指的是10-13秒。除了对蛋白酶体的介绍之外,下文还会出现核糖体的40S小亚基、60S大亚基等等,请读者注意识别。此外,下文将所有的26S蛋白酶体都简称为“蛋白酶体”。蛋白酶体的结构可在上页见到。)它有两个组分即20S核心蛋白酶与19S调节颗粒。核心蛋白酶的组分是α1、α2,……α7和β1-7——一共十四种蛋白质。α系列和β系列的蛋白质会分别形成一个七聚体,这样两个α七聚体和两个β七聚体(按照α-β-β-α的层次顺序,类似于弯曲的四指)构成28聚体的类似空心圆柱体“纸筒”或者“管子”的结构。但只有β七聚体具有催化活性。这个结构有强大的类胰蛋白酶、类糜蛋白酶、谷氨酰水解酶、支链氨基酸肽酶等等各种蛋白酶水解的活性。α七聚体的角色在于保证“滚筒绞肉机”不会伤及自身。靶蛋白最后要被泛素无情地拖进这个圆柱体的内部降解。而另外一个调节颗粒(还有一个别名叫PA700)则是由“基底”和“盖子”组成的,分别与核心蛋白酶的“管子”边缘的两个α七聚体结合。组成它的主要是调节颗粒AAA盒子-ATP酶(regulatory particle AAA(triple-A) ATPase, RPT)(这种蛋白质有个“AAA盒子”结构域,大概包含两百来个氨基酸,有兴趣的读者可以自己了解。)与调节颗粒非ATP酶(regulatory particle non-ATPase, RPN)。基底由六种RPT即RPT1-6,和三种RPN1,2和6组成;而盖子则由RPN3,5,9,11和12组成。
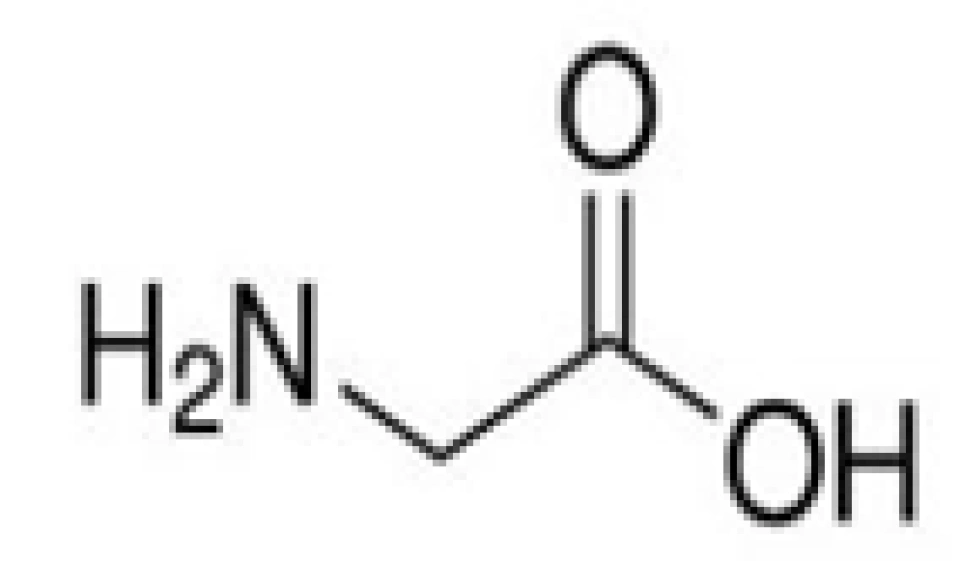
成熟的泛素分子含有76个氨基酸,它的游离羧基端(C端)有一个甘氨酸。
如果靶蛋白上有赖氨酸:
而且这个赖氨酸还位于适合与泛素相结合的位置,那么未来泛素的C端甘氨酸将会与赖氨酸的R基上的氨基(叫做ε-氨基)形成所谓的“异肽键”。(没错,R基上的氨基是可以形成肽键的!)具体来说,首先泛素活化酶E1(ubiquitin-activating enzyme, E1)与泛素结合。E1可以水解ATP成AMP(放出焦磷酸PP),让AMP与泛素的游离羧基端连接。
然后E1上的一个半胱氨酸会在E1催化下与泛素反应形成一个高能的硫酯键(所谓的硫酯键,就是酸脱羟基,(硫醇)巯基-SH脱氢,形成的-S-CO-化学键),从而将泛素激活。E1把泛素转移给E2(泛素连接酶,ubiquitin-conjugating enzyme, E2),E2也通过自己的一个半胱氨酸与泛素连接,而高能的硫酯键没有改变。然后E3(泛素-蛋白连接酶,ubiquitin-protein ligase, E3)再催化通过肽键将泛素连接到靶蛋白上,这个过程会消耗高能硫酯键的能量。
E1-3都有很多种,根据被泛素化的蛋白的不同而变化,以至于它们都可以形成自己的蛋白家族,它们也有可能是个复合体,由很多个蛋白质组成。泛素的48号氨基酸是一个赖氨酸,所以可以对泛素自己也加泛素,这样一直加,就形成泛素链。不过关于这个过程人们了解得不甚详细,所以提出了很多个模型来描述可能的泛素链形成途径,包括什么有序增加模型、秋千模型、杂合模型、指数模型等等,读者可以自行了解。靶蛋白在经过泛素化以后被运往蛋白酶体就是一个“既简单又复杂”的过程。说它简单,不过就是拉拉扯扯一下;说它复杂,它有很多个蛋白质参与:Rad23(radiation 23)、Kar2首要抑制物(dominant suppressor of Kar2,DSK2)、DNA损伤分子1(DNA damage molecule-1,Ddi1)、Shp1/p47等等。最后要运送到哪里呢?它的目的地正是26S蛋白酶体。蛋白质被扔进蛋白酶体之后会发生什么,请读者自行脑补(坏笑)。
将靶蛋白送进“绞肉机”粉碎以后,泛素再循环酶就会出动。泛素再循环酶包括泛素C-末端水解酶、同工肽酶、去泛素化酶(deubiquitination enzyme, DUB)。这个泛素C-末端水解酶会切割泛素前体的C端的几个氨基酸,然后才会暴露出它的甘氨酸末尾,由此泛素前体才能成为成熟的泛素蛋白。去泛素化酶可以将泛素从错误标记的靶蛋白上面移除,也能在靶蛋白被蛋白酶体降解之前将泛素先取下来。事实上泛素可以多次使用,单个泛素分子在细胞内的存在时间可以很长。
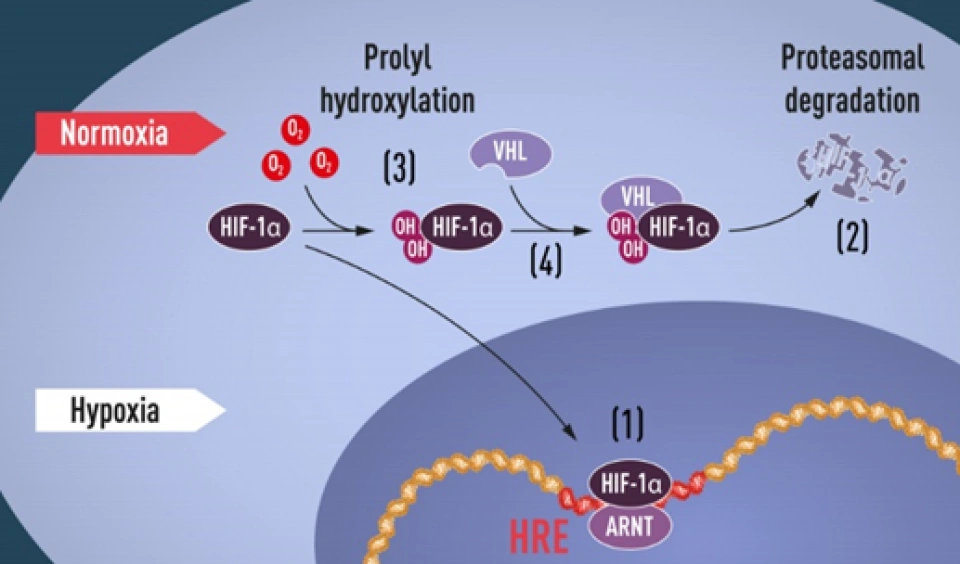
HIF-1α的最重要的E3酶的最为关键的组分是冯·希佩尔-林道肿瘤抑制蛋白(von Hippel-Lindau tumor suppressor protein(VHL))。
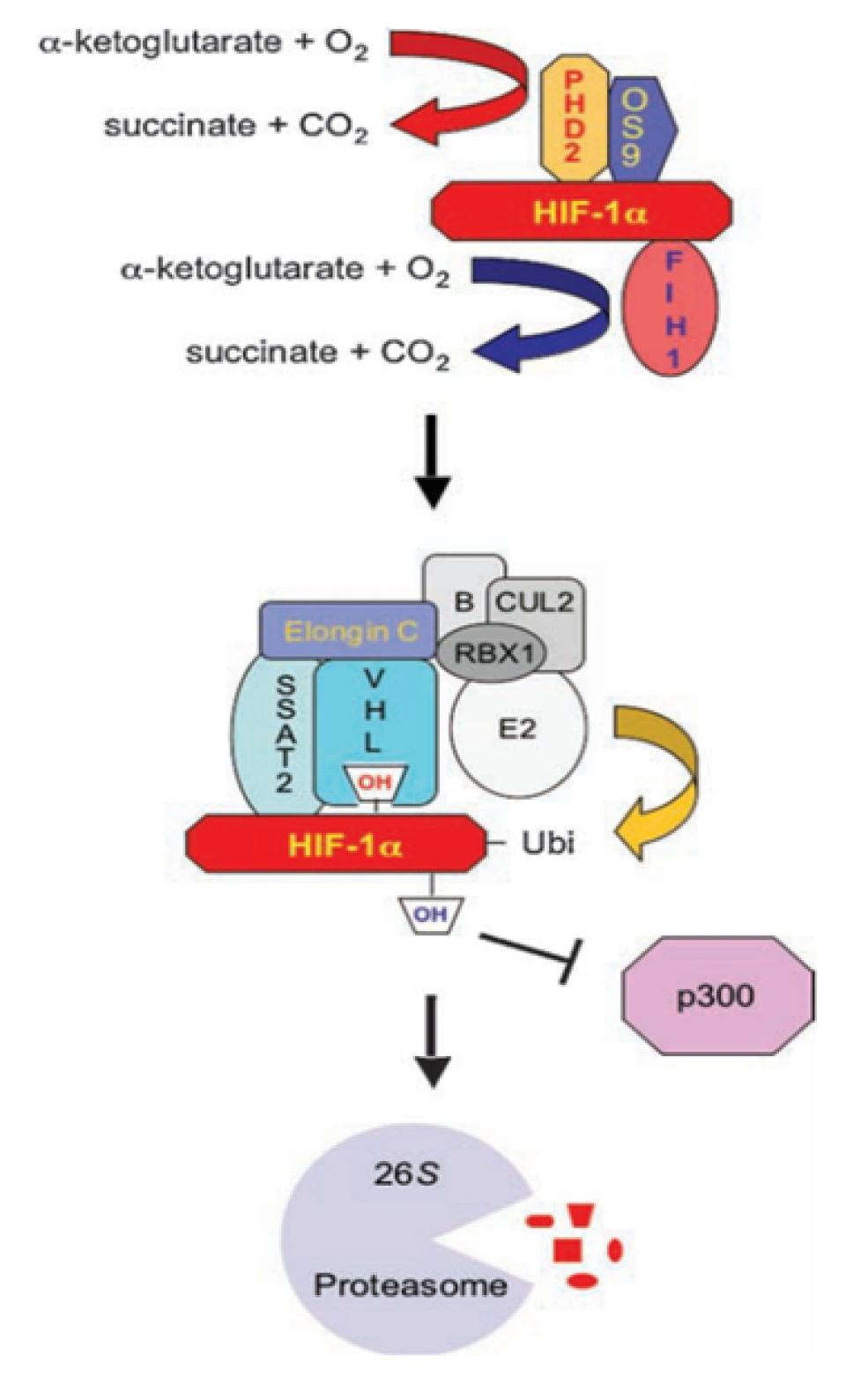
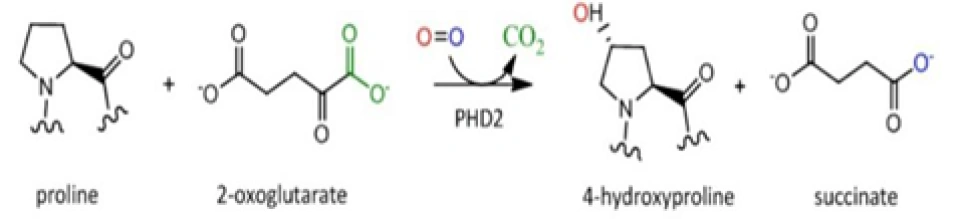
换句话说,一个最主要的HIF-1α的泛素降解途径,称为pVHL途径。但是如果要让冯·希佩尔-林道肿瘤抑制蛋白与HIF-1α结合,就必须先对HIF-1α作羟基化处理。HIF-1α的402号和(或)564号氨基酸都是脯氨酸。(其中564号这个脯氨酸位于HIF-1α的TAD-N结构域内。)它们会被双加氧酶(确切地说,叫做脯氨酸(酰)羟化酶结构域蛋白(prolyl hydroxylase-domain protein, PHD),目前发现了四种,即PHD1-3以及PHD-TM(PHD4),PHD2起主要作用。这个蛋白质家族还有其他名字:HIF prolyl hydroxylase(HIF脯氨酸残基羟化酶)、Egl nine homolog(EGLN)(Egl同源体9),原因是它的结构跟产蛋缺陷蛋白(egg-laying defective, Egl)高度相似。不过值得提醒和很有意思的是,PHD与EGLN的编号未必是一一对应关系,PHD2是EGLN1,PHD1是EGLN2,PHD3是EGLN3。人们对PHD4的结构知之甚少,现在无法确定)加上羟基:
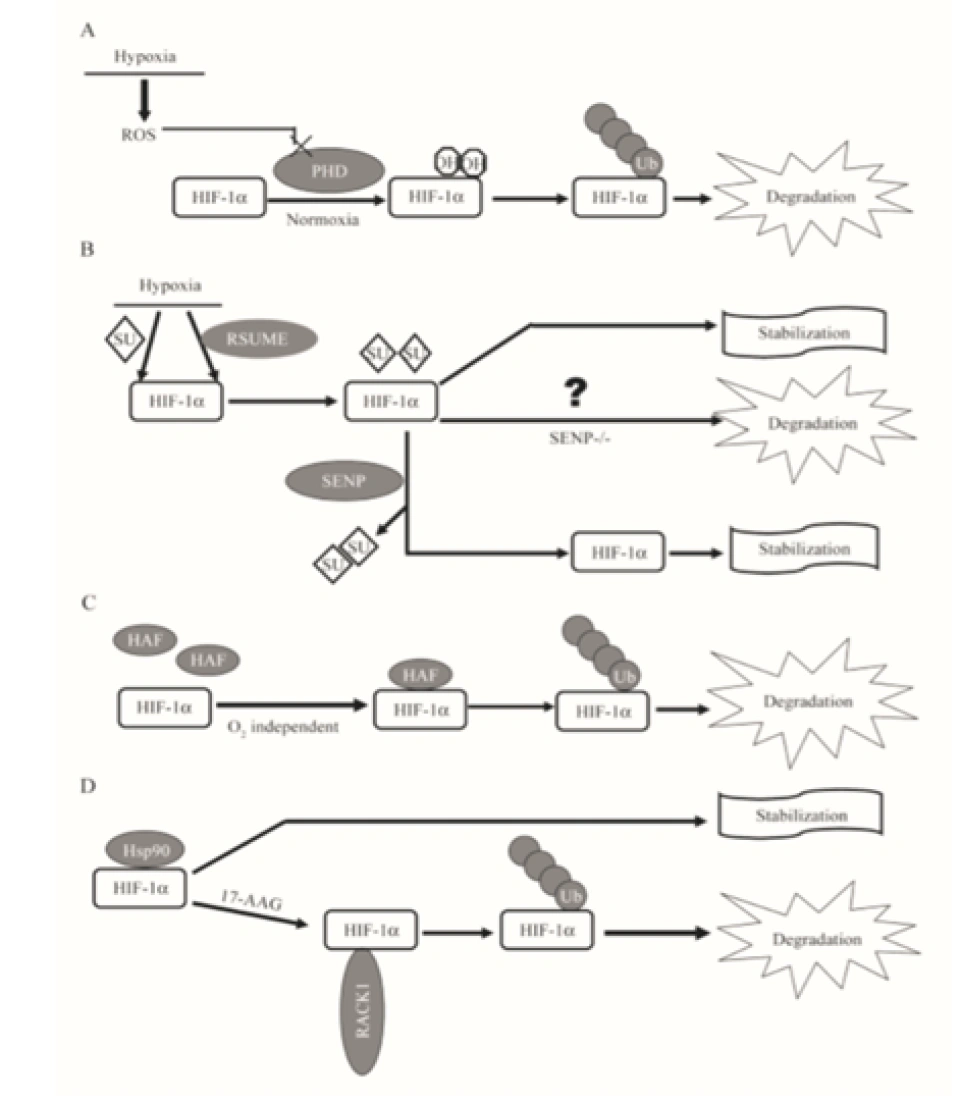
具体来说,氧气会被双加氧酶用作底物。双加氧酶会将氧分子拆开。首先一个氧原子被插入HIF-1α的脯氨酸残基,从而形成4-羟基;另一个氧原子被插入α-酮戊二酸(α-ketoglutarate),从而形成琥珀酸(succinate)和二氧化碳,作为这个反应的副产物。另外一个蛋白质OS9(又叫内质网凝集素(endoplasmic reticulum lectin, ERL)),能够同时结合HIF-1α和PHD2,促进脯氨酸的羟基化。此外,HIF-1α的532号氨基酸(是一个赖氨酸,位于HIF-1α的TAD-N结构域内。)被停滞缺陷蛋白(arrest-defective protein 1,ARD)加上一个乙酰基,也能促进VHL与HIF-1α的结合。冯·希佩尔-林道肿瘤抑制蛋白与HIF-1α结合时,就会结合到被羟基化的脯氨酸位点上。结合到HIF-1α的VHL随即招募亚精胺/精胺-N1-转乙酰基酶2(Spermidine/spermine-N1-acetyltransferase-2, SSAT2)和延伸因子(elongin)C,这两个蛋白质再招募E3泛素连接酶复合体(E3 ubiquitin-ligase complex)。这个复合体包含了延伸因子B、滞蛋白(cullin, CUL)2、环盒子蛋白1(RING-box protein 1, RBX1)以及E2泛素连接酶,能催化对HIF-1α的泛素化。因为这个过程对氧气是高度依赖的,所以在缺氧条件下,HIF-1α的分解被大幅减少,从而导致HIF-1的水平上调。同时,如果使用一些抑制剂抑制这些蛋白,那么同样也可以导致HIF-1的水平上调。二氧化钴、去铁胺就是利用类似的原理来上调HIF-1的水平的。
当然,这种方法虽然十分重要,但不是唯一给HIF-1α加泛素的方法。比如一种2008年才发现的缺氧相关因子HAF(hypoxia-associated factor),它也具有HIF-1α的泛素蛋白连接酶E3的活性。因此,HAF的存在会导致HIF-1α以及HIF-1下调。RACK1,即receptor for activated kinase C1(活化的蛋白激酶C受体1)也能修饰HIF-1α。RACK1是一个蛋白质的名字,也是一个七横八竖的信号通路的名字。它其实是作为蛋白激酶CβII(PKCβII)的受体被发现的(PKC通路,那也是一个信号通路),可以作为PKCβII的转位蛋白,把PKCβII拽到别的地方去跟其他的蛋白质反应,联系了MAPK信号通路、Src信号通路、PKC信号通路。而它也能结合到HIF-1α,从而大大地促进HIF-1α与E3连接酶的结合,这样就相当于推动了HIF-1α的泛素化降解。不过,热休克蛋白90(Hsp90)可以与RACK1竞争位于HIF-1α分子上的结合位置,从而保护HIF-1α。虽然Hsp90对HIF-1α起保护作用,但另一种热休克蛋白——Hsp70,却会增强Hsp70羧基端互作蛋白(carboxyl terminus of Hsp70-interacting protein, CHIP)对HIF-1α的修饰作用。而CHIP正好是一种只针对HIF-1α的E3泛素-蛋白连接酶。在短期极度缺氧条件下,细胞内过度积累的丙酮酸反而会下调HIF-1α的水平,此时HIF-1α的分解就是靠CHIP/Hsp70来进行的。
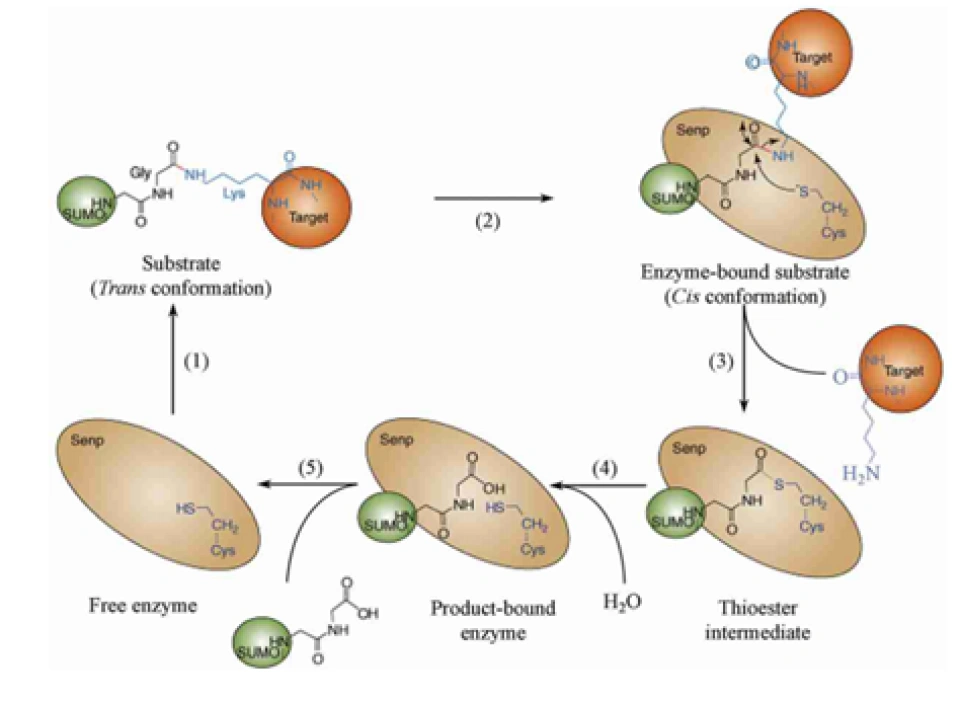
小泛素相关修饰物(small ubiquitin-related modifier, SUMO)途径,是继泛素-蛋白酶体途径之后又一发现的修饰HIF-1α的方式之一,而且SUMO激活和修饰靶蛋白的方法都与泛素特别像。
SUMO是一类蛋白质,又叫sentrin,至少发现了SUMO1、SUMO2、SUMO3、SUMO4这四种。(SUMO4只在肾脏和免疫器官表达,当然不是HIF-1α的主要修饰者。SUMO2-3与泛素一样也含有能够继续结合SUMO蛋白的赖氨酸,也许它们也可以连环加SUMO蛋白。)它可能被加到HIF-1α的391号和477号氨基酸(都是赖氨酸)。但在这之前,它同样会经历一系列成熟、活化、连接之类的修饰。因为SUMO蛋白最开始也是以没有活性的蛋白的形式存在的。以后的步骤基本跟泛素相同。切它C端的酶叫做泛素样蛋白加工酶(ubiquitin-like protein specific protease, ULP),ULP还有一个名称,叫做SUMO特异性蛋白酶(SUMO-specific protease, SENP)。SENP在人体内至少发现了9种。SUMO活化酶E1是异源二聚体,它由SUMO活化酶亚单位1和2(SUMO-activating enzyme subunit 1&2)构成。这两个蛋白质分别又称作Aos1和Uba2——Aos是activation of Smt3p 1(smt3不过是SUMO-1的另一种说法)的缩写,Uba是Ubiquitin-Like Modifier-Activating Enzyme 的缩写。SUMO的E2酶叫做Ubc9。SUMO的E3连接酶则有很多种,包括Ran结合蛋白2(Ran binding protein 2,RanBP2,Ran是Ras蛋白超家族的一员。Ran是指Ras相关核蛋白(Ras-related nuclear proteins)也叫GFP结合核蛋白Ran(GTP-binding nuclear protein Ran)、活化STAT蛋白抑制蛋白(protein inhibitor of activated STAT, PIAS,STAT就是signal transducer and activator of transcription即信号转导及转录激活蛋白,STAT通路是名声响亮的级联通讯路径)、Pc2 (polycomb protein 2,polycomb确实可以粗略理解为“多重梳子”,一种特别的结构域)、色素框同源物4(chromobox 4,CBX4)等等,在其他生物身上就更多了。最终给靶蛋白加上SUMO的过程叫做SUMO化(SUMOylation),2007年发现,RWD结构域SUMO化增强蛋白:RWD-containing SUMOylation enhancer, RSUME。RWD的名字来源于三个比较典型的包含这个结构域的蛋白质:环指结构域蛋白(RING finger-containing proteins)、WD基元结构域蛋白(WD-repeat-containing proteins,WD基元又叫色氨酸-天冬氨酸或WD40)和酵母死亡样解旋酶(yeast DEAD-like helicases)能促进这个反应。相反的过程就是去SUMO化(deSUMOylation)了,SENP催化了这个过程,分子机理可以见图。
那么SUMO蛋白到底有何用处?科学家曾似乎对此莫衷一是,有更多观点倾向于认为它是防止HIF-1α被降解的蛋白质。(但也许有可能是抑制它的活性。)如果SUMO一直与HIF-1α结合着,就会保护它,否则它就被降解。有很多研究发现SUMO蛋白质的表达受到氧含量的影响,这是否意味着氧含量还可以通过这样的途径间接调控HIF-1的水平呢?
除上述途径外,HIF-1α蛋白的修饰还存在其他的机制。例如在巨噬细胞中 HIF-1α第533位Cys的S-亚硝基化可增强HIF-1α的稳定性;c-Jun能够通过与HIF-1α的ODD结构域的结合来阻止HIF-1α经由泛素化途径降解。有意思的是,如果读者注意到的话,RACK1能通过抑制FBW7对c-Jun的促进作用来抵消c-Jun的作用。此外,在之前说到的泛素途径中,HIF-1抑制因子(factor inhibiting HIF-1, FIH-1)会以与PHD2同样的方式将HIF-1α的803号氨基酸(一个天冬酰胺,位于HIF-1α的TAD-C结构域内。)羟基化。这个操作将会抑制HIF-1α与组蛋白乙酰化和脱乙酰化调节因子CBP/p300(CBP是CREB-binding protein(CREB结合蛋白)的缩写,CREB是cAMP response element -binding protein(环磷酸腺苷(cAMP)反应元件结合蛋白)的缩写)的结合,从而扼杀HIF-1α调控转录的能力。但这一步也是依赖氧气的,所以缺氧会让这种结合被阻碍,从而HIF-1α的活性就被恢复。
先介绍到这里,我们下期见
Key publications & Referecences:
Semenza, G.L, Nejfelt, M.K., Chi, S.M. & Antonarakis, S.E. (1991). Hypoxia-inducible nuclear factors bind to an enhancer element located 3’ to the human erythropoietin gene. Proc Natl Acad Sci USA, 88, 5680-5684
Wang, G.L., Jiang, B.-H., Rue, E.A. & Semenza, G.L. (1995). Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci USA, 92, 5510-5514
Maxwell, P.H., Wiesener, M.S., Chang, G.-W., Clifford, S.C., Vaux, E.C., Cockman, M.E., Wykoff, C.C., Pugh, C.W., Maher, E.R. & Ratcliffe, P.J. (1999). The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature, 399, 271-275
Mircea, I., Kondo, K., Yang, H., Kim, W., Valiando, J., Ohh, M., Salic, A., Asara, J.M., Lane, W.S. & Kaelin Jr., W.G. (2001) HIFa targeted for VHL-mediated destruction by proline hydroxylation: Implications for O2 sensing. Science, 292, 464-468
Jakkola, P., Mole, D.R., Tian, Y.-M., Wilson, M.I., Gielbert, J., Gaskell, S.J., von Kriegsheim, A., Heberstreit, H.F., Mukherji, M., Schofield, C.J., Maxwell, P.H., Pugh, C.W. & Ratcliffe, P.J. (2001). Targeting of HIF-a to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science, 292, 468-472
Figure origins:
第3面上、下:维基百科
第4面上:Jawahar L. Mehta, Naranjan S. Dhalla. Biochemical Basis and Therapeutic Implications of Angiogenesis[J]. 2013.,p94
第4面下:百度百科,作者用PS删去了水印
第5面:Lee, J.-W., Bae, S.-H., Jeong, J.-W., Kim, S.-H., & Kim, K.-W. (2004). Hypoxia-inducible factor (HIF-1)α: its protein stability and biological functions. Experimental & Molecular Medicine, 36(1)
第6面:https://www.nobelprize.org/prizes/medicine/2019/press-release/
第7面上:Dong Y , Zhang S , Wu Z , et al. Cryo-EM structures and dynamics of substrate-engaged human 26S proteasome[J]. Nature, 2018.
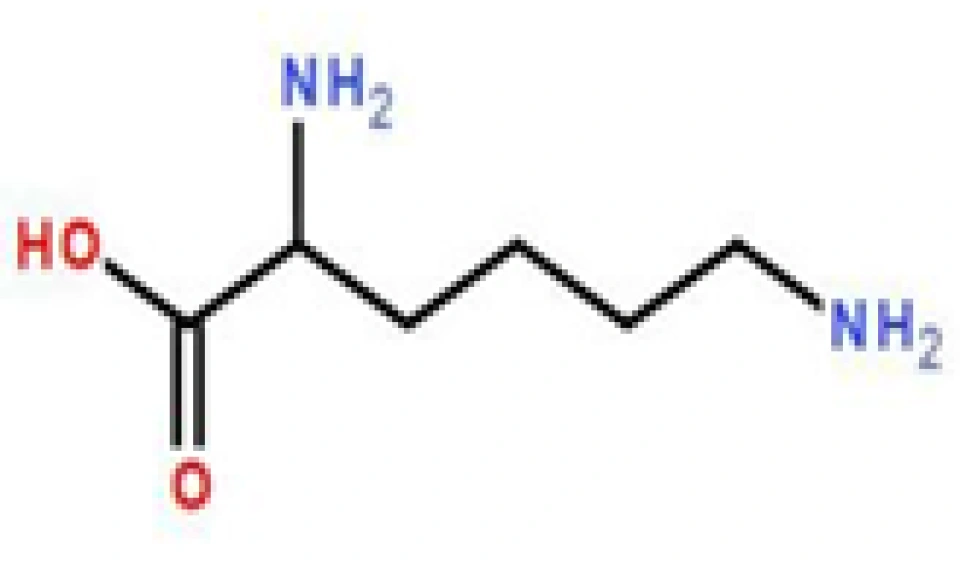
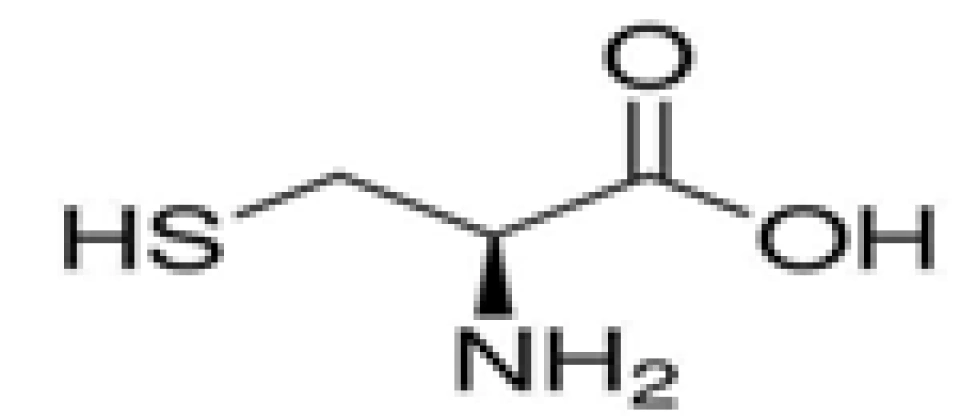
第7面下(三张氨基酸结构图):略
第8面:https://www.sohu.com/a/226986201_282570
第9面上:Gabriel G. Haddad, Shan Ping Yu. Brain Hypoxia and Ischemia[M]. Humana Press, 2009.,p279
第9面下:略
第11面:Mahajan R , Delphin C , Guan T, et al. A small ubiquitin2related polypeptide involved in targeting RanGAP1 to nuclear pore complex protein ranbp2[J ]. Cell ,1997 ,88(1) :972107
第12面:姚青, 李筠, 张鹏,等. 缺氧诱导因子-1和缺氧诱导因子-2:结构、功能及调节[J]. 生命科学, 2011(08):35-43.
第13面:维基百科


















奖励金币:10
奖励理由:内容丰富饱满